6.3: Conformación de Butano
- Page ID
- 80699
En el caso del etano, los cambios conformacionales son muy sutiles, pero en otros son más obvios. El butano (CH 3 CH 2 CH 2 CH 3) tiene cuatro carbonos tetraédricos y tres enlaces carbono-carbono que los conectan entre sí. Numeremos los carbonos a lo largo de la cadena C1, C2, C3 y C4. Girando alrededor de los enlaces C-C conectados a los carbonos terminales, C1-C2 y C3-C4, solo serían evidentes cambios sutiles en la forma. Sin embargo, rotar alrededor de C2-C3 produce algunos cambios de forma bastante obvios.
Preste atención a dónde están los dos grupos metilo uno con respecto al otro. Si llamamos a C1-C2-C3-C4 el ángulo diedro, entonces a 0 grados la molécula se encuentra en una conformación eclipsada, aparente al mirar la proyección de Newman. Mirada desde otros puntos de vista, la molécula está acurrucada en forma de letra C.
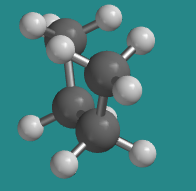
Ir a Animación CA3.1. Un modelo tridimensional de butano en conformación eclipsada.

La conformación “eclipsada menos estable” se describe de esa manera porque hay dos conformaciones eclipsadas diferentes; pronto veremos la otra. De las dos conformaciones eclipsadas, esta es menos estable que la otra. En una conformación eclipsada, los enlaces que provienen de dos átomos vecinos se alinean entre sí. El ángulo diedro entre estos enlaces —el enlace C1-C2 y el enlace C3-C4 en el caso de la conformación eclipsada menos estable del butano— es de 0°. Esa situación introduce tensión torsional. En consecuencia, ninguna de estas conformaciones eclipsadas es muy estable.
A 60 grados, la molécula ya no está eclipsada, y al igual que en el etano la energía es un poco menor, pero la forma general cuando se ve desde un lado sigue siendo una especie de C. Esta forma es una de las dos posibles conformaciones escalonadas, en las que no hay tensión torsional.
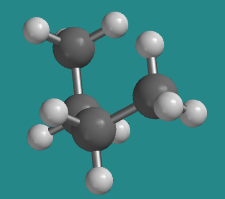
Ir a Animación CA3.2. Un modelo tridimensional de butano en conformación gauche.

A 120 grados la molécula se vuelve a eclipsar, pero desde el lado ahora se ha torcido casi en una forma como la letra Z. Es claramente diferente de la otra conformación eclipsada. Esta es un poco más estable que la otra conformación eclipsada, por razones que veremos en breve. Se llama la “conformación eclipsada más estable”.
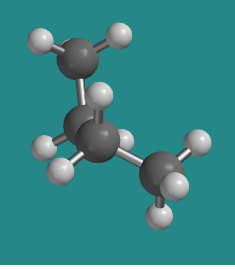
Ir a Animación CA3.3. Un modelo tridimensional de butano en conformación eclipsada.

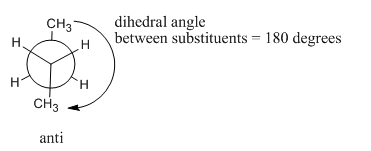
A 180 grados, la molécula vuelve a escalonarse y se ha asentado en forma de letra Z regular, en zig-zag. No hay tensión torsional, por lo que esta es una de las formas más estables que puede adoptar la molécula. Sin embargo, no es la misma forma que el otro conformador escalonado (el que llamamos “gauche”). A éste se le llama el “anti” confórmero.
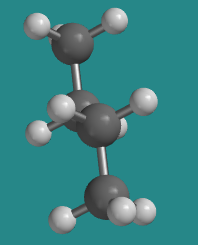
Ir a Animación CA3.4. Un modelo tridimensional de butano en anti confórmero.
Estas conformaciones de butano son realmente bastante diferentes. ¿Qué forma preferiría la molécula? Por lo que aprendimos sobre el etano, probablemente podríamos descartar las conformaciones eclipsadas. Cada uno de ellos tendría 3 kcal/mol de cepa torsional.
Sin embargo, hay otro factor que desestabiliza la conformación inicial a 0 grados, a favor de la en forma de Z con los grupos metilo separados 180 grados entre sí. Este factor se llama “estéricos” y se refiere a la idea de que las moléculas, o partes de moléculas, ocupan espacio, y así dos partes del butano no pueden ocupar el mismo lugar al mismo tiempo. En pocas palabras, los esterinos se refieren al hacinamiento. Cuando los dos grupos metilo en el butano están demasiado juntos, están demasiado abarrotados, y están a mayor energía. Cuando se separan más, el hacinamiento disminuye y la energía en la molécula baja.
- La deformación torsional obliga a que los enlaces en los carbonos vecinos se escalonen.
- La tensión estérica obliga a los grupos a alejarse unos de otros para aliviar el hacinamiento.
- La torsión y los estéricos contribuyen a la energía de deformación.
- La cepa se puede liberar poniendo la molécula en una conformación de menor energía.
Para el butano, eso significa alejar esos dos grupos metilo entre sí y mantener los enlaces escalonados.
Hay alguna jerga adicional que se utiliza para describir estas conformaciones de butano:
- En un anti confórmero, los grupos más grandes son 180 0 entre sí.
- En un conformador gauche, los enlaces están escalonados pero los grupos más grandes son 60 0 entre sí.
Debido a las diferentes interacciones estéricas, el conformador más estable es el anti confórmero. El segundo conformador más estable es el conformador gauche. Las otras formas que hemos mirado, las dos conformaciones eclipsadas, no son muy estables en absoluto. A temperatura ambiente, una botella de gas butano tiene suficiente energía para que las moléculas individuales puedan permitir que sus enlaces giren, muestreando diferentes formas. Sin embargo, en un momento dado, la mayoría de las moléculas se encontrarán en el anticonformador, ya que cada una de esas moléculas pasará la mayor parte de su tiempo en la conformación más estable. Algunas de las moléculas se encontrarán en el conformador gauche, porque esa es la segunda conformación más estable. Ninguna de las moléculas se encontrará en las conformaciones eclipsadas, porque esos son puntos de máxima energía. Las moléculas tienen suficiente energía para oscilar un poco hacia adelante y hacia atrás, y a veces no rotarán todo el camino a través de una conformación eclipsada, pero no se detendrán ahí. En cambio, seguirán rotando hasta llegar a otro conformador escalonado.
- Una molécula de butano pasa la mayor parte de su tiempo en el anti cofrmer.
- Una molécula de butano pasa parte de su tiempo en el conformador gauche.
- Una molécula de butano no pasa casi nada de su tiempo en conformaciones eclipsadas.
Tenga en cuenta que tenemos dos palabras muy similares: conformación y conformador. Están relacionados, pero no lo mismo.
- Una conformación es cualquier forma que una molécula pueda adoptar.
- Un conformador es una conformación que es lo suficientemente estable como para que una molécula pueda adoptar durante una cantidad significativa de tiempo.
Ejercicio\(\PageIndex{1}\)
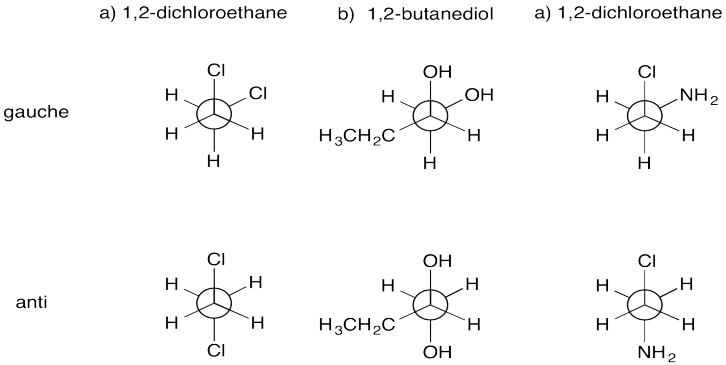
Dibujar proyecciones de Newman de los siguientes compuestos en una gauche y una anti conformación.
- 1,2-dicloroetano (\(\ce{ClCH2CH2Cl}\))
- 1,2-butanodiol (\(\ce{CH3CH2CH(OH)CH2OH}\))
- 2-cloroetilamina (\(\ce{ClCH2CH2NH2}\))
- Responder
-
Fotos fijas de modelos obtenidos usando Spartan 14 de Wavefunction, Inc., Irvine, California.

