6.12: Anillos con Heteroátomos
- Page ID
- 80692
Los anillos a menudo contienen átomos distintos del carbono. En muchos casos, todavía se adopta la misma forma básica del compuesto carbocíclico. Por ejemplo, reemplazar un carbono de ciclohexano por un oxígeno, como en el tetrahidropirano, conserva la misma forma básica de silla.
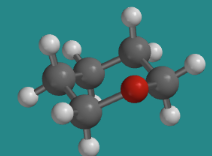
Ir a Animación CA12.1. Un modelo tridimensional de tetrahidropirano.
La estructura del tetrahidropirano es común en la naturaleza, apareciendo con mayor frecuencia en forma de azúcares como la glucosa. La glucosa tiene una serie de formas diferentes que existen en equilibrio. La forma predominante en solución acuosa es β-D-glucopiranosa.
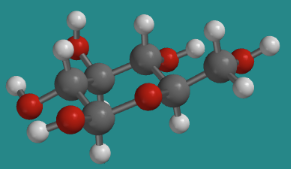
Ir a Animación CA12.2. Un modelo tridimensional de β-D-glucopiranosa.
Ejercicio\(\PageIndex{1}\)
Dibuja β-D-glucopiranosa en una silla. Marcar cada sustituyente axial o ecuatorial. Realice un giro de anillo y compare la tensión estérica en los dos conformadores.
- Contestar
-
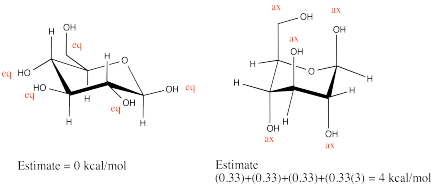
Uno de los otros isómeros en equilibrio con β-D-glucopiranosa en solución es α-D-glucopiranosa. Los dos isómeros son casi idénticos entre sí, excepto que un grupo hidroxilo apunta a una dirección diferente.
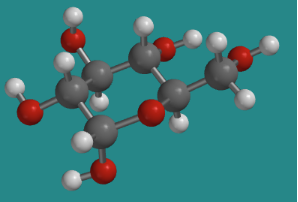
Ir a Animación CA12.3. Un modelo tridimensional de α-D-glucopiranosa.
Ejercicio\(\PageIndex{2}\)
Comparar la cepa estérica en los dos isómeros de glocopiranosa. ¿Cuál isómero debería ser el principal?
- Contestar
-
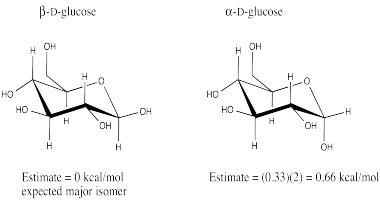
Podemos aislar nuevamente esa estructura de tetrahidropirano central del azúcar, trayendo consigo el grupo hidroxilo que difiere entre los dos isómeros de la glucosa. En uno de los isómeros de glucosa, el grupo hidroxilo se encuentra en una posición axial, como lo está en esta conformación axial del 1-hidroxitretrahidropirano.
Ir a Animación CA12.4. Un modelo tridimensional de 1-hidroxitretrahidropirano.
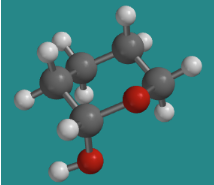
En el otro isómero de glucosa, el grupo hidroxi se encuentra en una posición ecuatorial, como lo es en esta conformación ecuatorial de 1-hidroxitretrahidropirano.
Ir a Animación CA12.5. Un modelo tridimensional de 1-hidroxitretrahidropirano.
Ejercicio\(\PageIndex{3}\)
Se observa un efecto inusual en los casos en los que un oxígeno en un anillo se une a un carbono que también contiene un grupo OH (ver dibujos anteriores). Este grupo O-C-OH se denomina hemiacetal. En un anillo de seis miembros, el hemiacetal se pudo encontrar en dos posiciones isoméricas diferentes. En los azúcares, estas se denominan posiciones alfa y beta.
a) Con base en consideraciones estéricas, ¿cuál de estos dos isómeros debería ser más estable?
b) Estos dos isómeros existen en equilibrio entre sí. ¿Cuál isómero debería ser la especie principal presente?
c) En disolventes de polaridad modesta, como el diclorometano, un factor distinto a los estéricos invierte realmente este equilibrio; el compuesto estéricamente desfavorecido se vuelve más estable. ¿Qué factor crees que es el responsable de este fenómeno?
d) En disolventes de alta polaridad, como el agua, el factor en cuestión (c) se vuelve menos importante, y los esterinos dominan el equilibrio. ¿Por qué un ambiente altamente polar disminuiría el efecto discutido en la parte c)?
- Respuesta a:
-
El isómero β-D-glucosa debería ser el isómero más estable. El isómero β-D-glucosa coloca al grupo hidroxilo C1 en la posición ecuatorial.
- Respuesta b:
-
El isómero β-D-glucosa debería ser el isómero más abundante.
- Respuesta c:
-
Esto se debe a algo llamado el efecto anomérico. En disolventes de polaridad modesta, como el dicolorometano, el isómero α-D-glucosa no es tan polar como el isómero β-D-glucosa. En el isómero α-D-glucosa los dipolos del anillo oxígeno y el grupo hidroxilo C1 se oponen entre sí (por lo tanto el efecto general es que la molécula es menos polar). Además, el isómero α-D-glucosa se estabiliza por hiper conjugación del oxígeno del anillo y C1. Para obtener más información, consulte http://en.Wikipedia.org/wiki/Anomeric_effect
- Respuesta d:
-
Un ambiente más polar promovería tener más del isómero β-D-glucosa alrededor. En el isómero β-D-glucosa, los dipolos del oxígeno del anillo y el grupo hidroxilo C1 se alinean entre sí (por lo tanto el efecto general es que la molécula es más polar).
Anillos inflexibles
Muchos anillos no sufren cambios conformacionales porque no son muy flexibles. Frecuentemente estos anillos contienen una serie de dobles enlaces; recuerde que no se permite la rotación alrededor de un doble enlace porque el enlace se rompería.
Por ejemplo, el ciclohexano es un anillo de carbono de seis miembros que tiene una estructura de silla. Es flexible y puede sufrir cambios conformacionales. El benceno también es un anillo de carbono de seis miembros, pero no tiene una estructura de silla. Es plano y rígido. No puede sufrir cambios conformacionales, porque ninguno de sus enlaces C-C puede rotar.
- El benceno no sufre cambios conformacionales debido a la unión deslocalizada alrededor del anillo.
- Este anillo aromático es completamente plano, maximizando la interacción entre los orbitales de unión p.
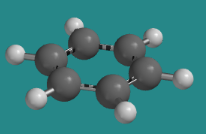
Ir a Animación CA12.6. Un modelo tridimensional de benceno.
Otros anillos también muestran deslocalización aromática en la que también participan heteroátomos. En algunos casos, el heteroátomo simplemente participa en un doble enlace regular. En otros, el heteroátomo dona un par solitario al sistema π.
El furano es un ejemplo en el que un par solitario del oxígeno se deslocaliza para alcanzar la estabilidad aromática.
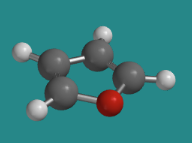
Ir a Animación CA12.7. Un modelo tridimensional de furano.
La piridina es un ejemplo en el que el anillo tiene deslocalización aromática, pero el par solitario en el nitrógeno no participa. Debido a que el nitrógeno ya tiene un enlace p, el par solitario es ortogonal a ese enlace, y se encuentra en el plano del anillo.
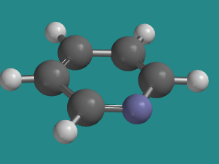
Ir a Animación CA12.8. Un modelo tridimensional de piridina.
Fotos fijas de modelos obtenidos usando Spartan 14 de Wavefunction, Inc., Irvine, California.

