6.15: Soluciones a problemas seleccionados
- Page ID
- 80691
Ejercicio 6.3.1:
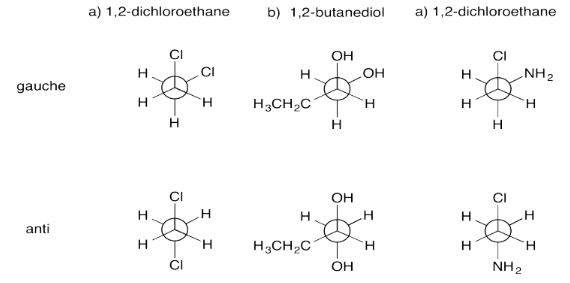
Ejercicio 6.4.1:
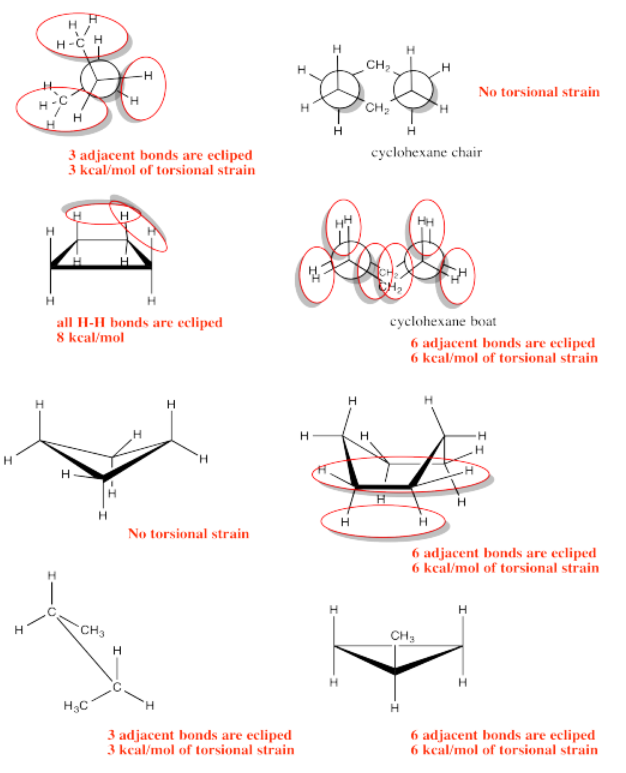
Ejercicio 6.4.2:
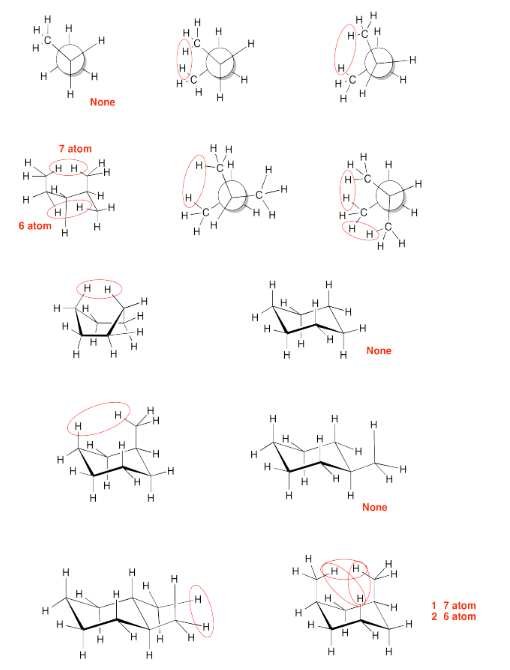
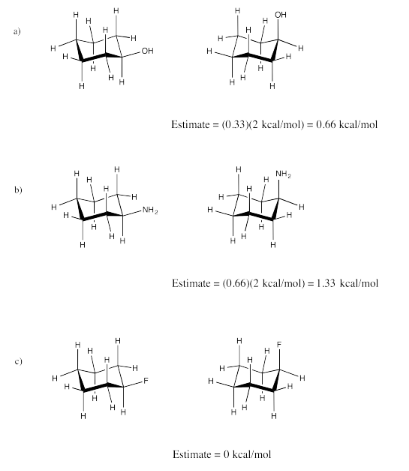
Ejercicio 6.4.3a:
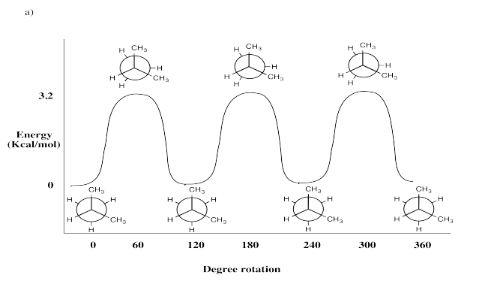
Ejercicio 6.4.3b:
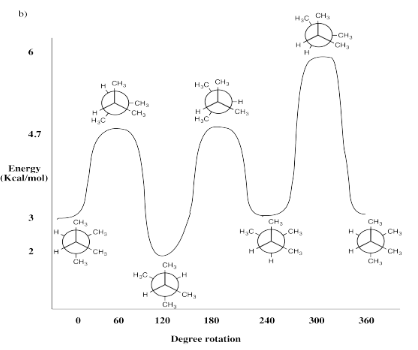
Ejercicio 6.4.3c:
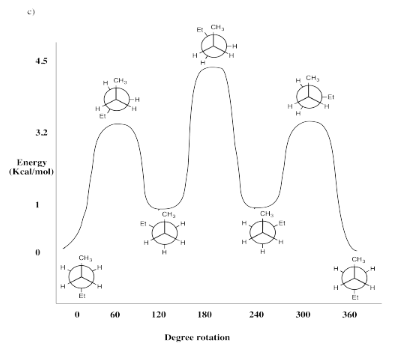
Ejercicio 6.8.1:
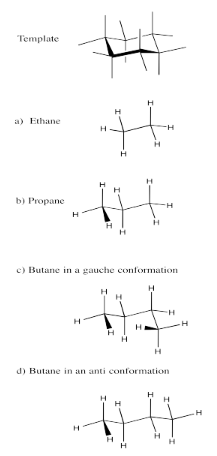
Ejercicio 6.9.1
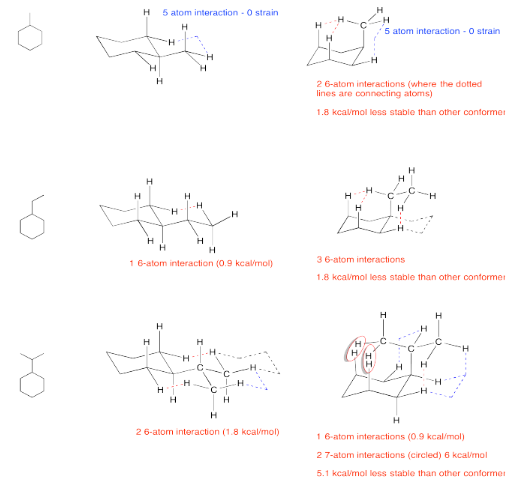
Ejercicio 6.9.2:
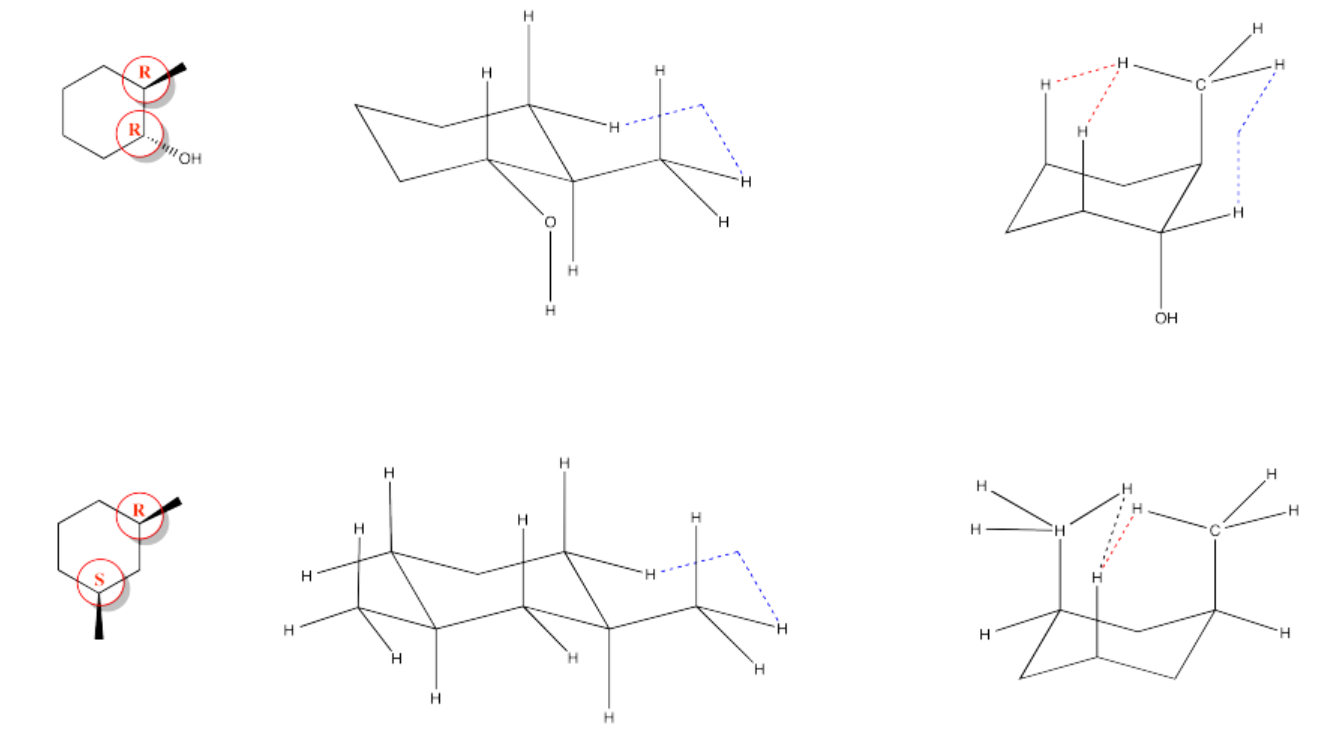
Ejercicio 6.9.3:
Ejercicio 6.10.1:

Ejercicio 6.10.2:
Ejercicio 6.10.3:
Ejercicio 6.10.4:
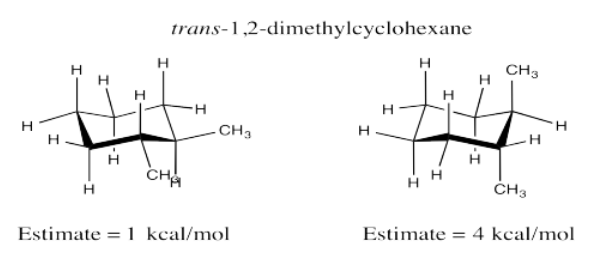
Ejercicio 6.10.5:
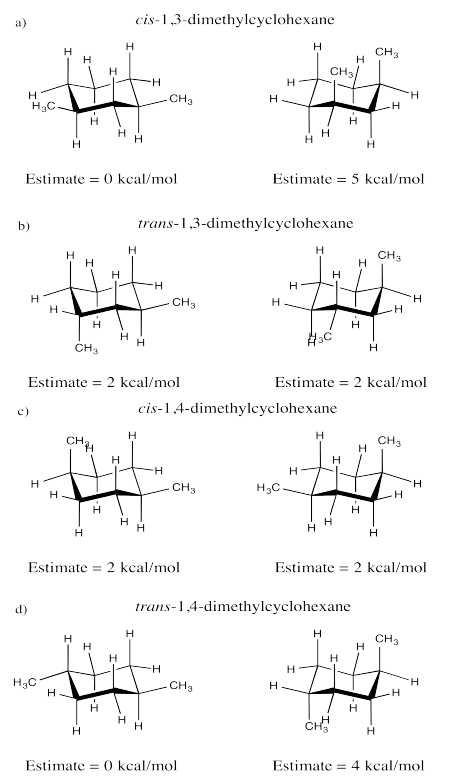
Ejercicio 6.11.1:
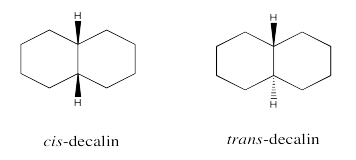
Ejercicio 6.11.2:
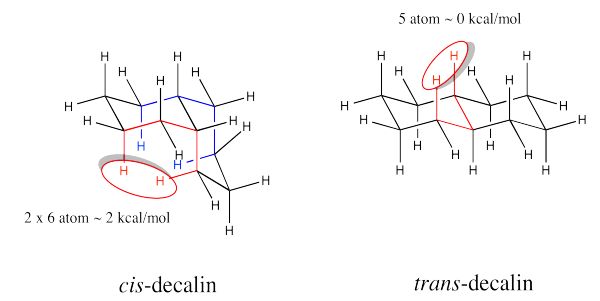
Ejercicio 6.11.3:
- Los sustituyentes son siempre trans a lo largo de las uniones entre cada par de anillos. Los esteroides se asemejan a una serie de estructuras de trans-decalina.
- La estructura general sería más ancha y ondulada como una trans-decalina, en lugar de rizada o encajada como una cis-decalina.
Ejercicio 6.11.4:
Biciclo [2.2.0] decano
Ejercicio 6.11.5:
a) Biciclo [2.1.1] hexano b) Biciclo [3.2.1] octano c) Biciclo [2.1.0] pentano (más comúnmente llamado “housane”)
d) Biciclo [2.2.2] octano e) cis- biciclo [3.3.0] octano
f) cis- Biciclo [1.1.0] butano g) Biciclo [1.1.1] pentano h) Biciclo [4.3.3] dodecano
Ejercicio 6.11.6:
Aunque podríamos esbozar muchos anillos usando adamantano, solo se necesitan tres anillos para incluir todos los átomos de carbono en la estructura. Así, el adamantano se considera un sistema tricíclico. La nomenclatura sistemática de los sistemas tricíclicos se complica un poco más, así que no nos preocuparemos por eso.
Ejercicio 6.11.7:
Si el ciclodecano adoptara una conformación regular de celosía de diamante, habría una enorme interacción de 8 átomos en el medio del anillo. Esa interacción ni siquiera está incluida en nuestro conjunto de bases. Costaría al menos 6-7 kcal/mol. Como resultado, el ciclodecano adopta una estructura retorcida para evitar esta interacción.
Ejercicio 6.11.8:
Ejercicio 6.11.9:
Ejercicio 6.12.1:
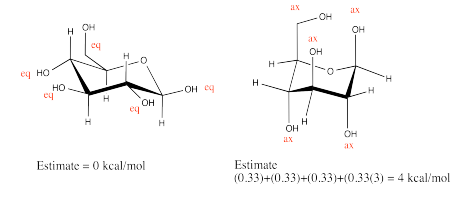
Ejercicio 6.12.2:
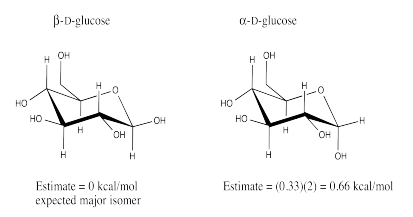
Ejercicio 6.12.3:
a) El isómero β-D-glucosa debería ser el isómero más estable. El isómero β-D-glucosa coloca al grupo hidroxilo C1 en la posición ecuatorial.
b) El isómero β-D-glucosa debería ser el isómero más abundante.
c) Esto se debe a algo llamado el efecto anomérico. En disolventes de polaridad modesta, como el dicolorometano, el isómero α-D-glucosa no es tan polar como el isómero β-D-glucosa. En el isómero α-D-glucosa los dipolos del anillo oxígeno y el grupo hidroxilo C1 se oponen entre sí (por lo tanto el efecto general es que la molécula es menos polar). Además, el isómero α-D-glucosa se estabiliza por hiper conjugación del oxígeno del anillo y C1. Para mayor información ver http://en.Wikipedia.org/wiki/Anomeric_effect
d) Un ambiente más polar promovería tener más del isómero β-D-glucosa alrededor. En el isómero β-D-glucosa, los dipolos del oxígeno del anillo y el grupo hidroxilo C1 se alinean entre sí (por lo tanto el efecto general es que la molécula es más polar).
Ejercicio 6.13.1:
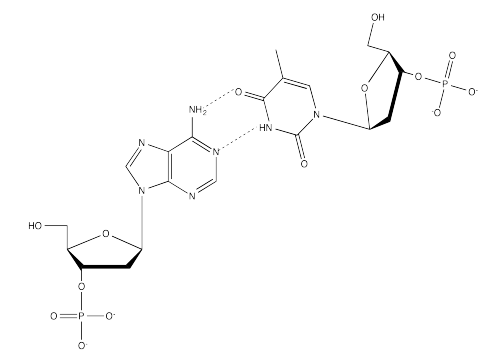
Ejercicio 6.13.2:
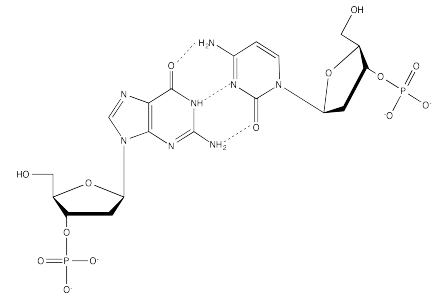
Ejercicio 6.13.3:
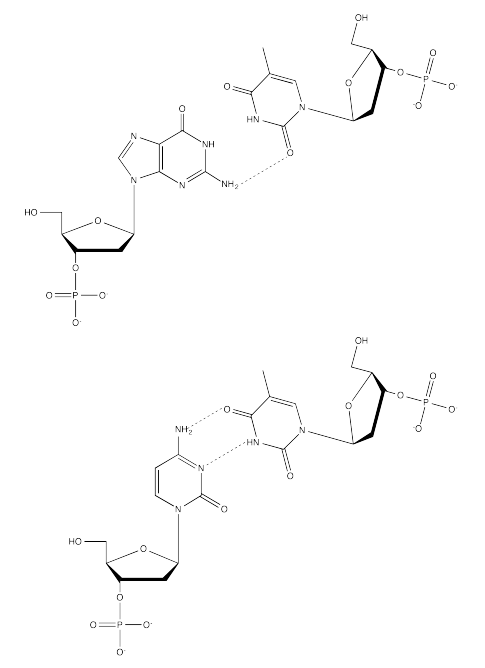
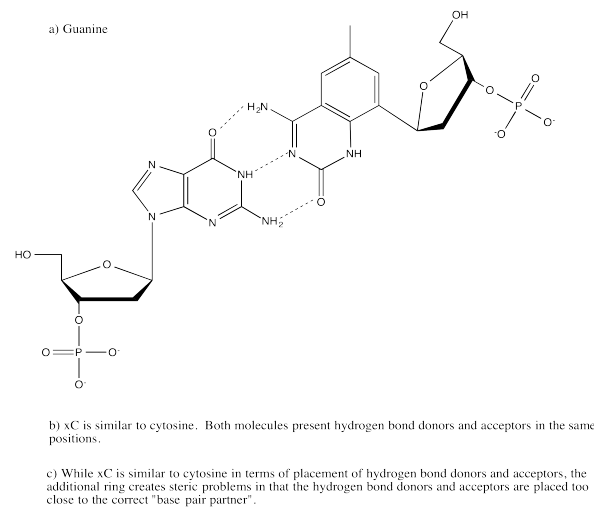
Ejercicio 6.13.4:
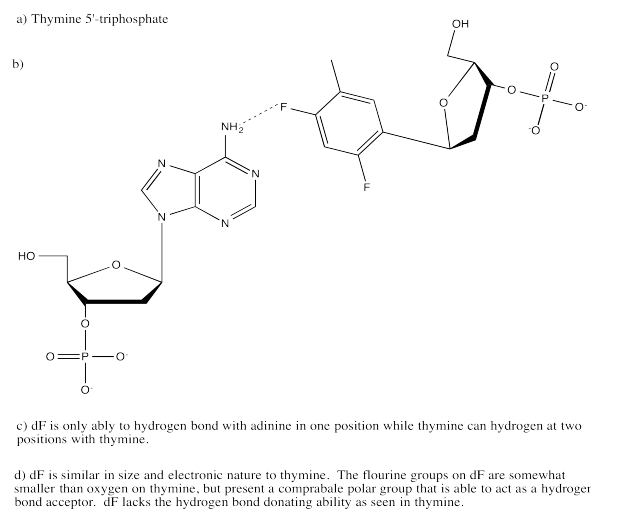
Ejercicio 6.13.5:
Ejercicio 6.14.1:
a)
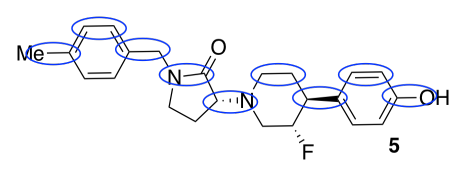
b) alrededor de 9 Å
c)
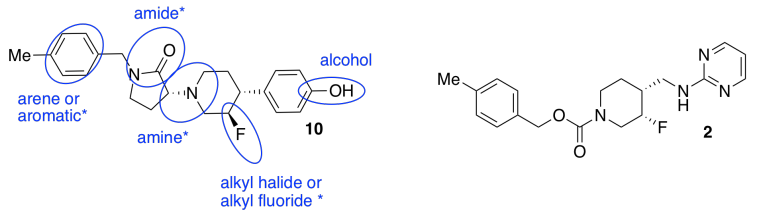
d) Estereoquímica. Debido a que los receptores biológicos son generalmente proteínas que contienen sitios de unión únicos y quirales, esperan encontrar un estereoisómero que se ajuste al receptor GluN2b, pero no al receptor hERG.
e) Estos compuestos son diastereómeros entre sí.
f)
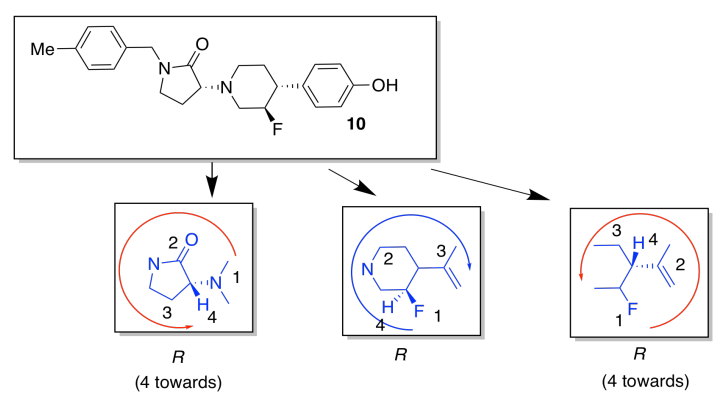
g)
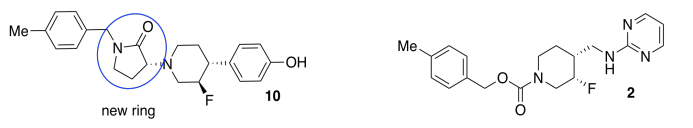
h)
El anillo introduce rigidez conformacional al evitar que la unión se someta a una rotación completa; se ata hacia atrás por la conexión en el otro lado del anillo.
i) Estaban tratando de disminuir el número de posibles conformaciones, o formas, que el compuesto pudiera adoptar. De esa manera, sería menos probable que se uniera tanto en el receptor GluN2b como en el receptor hERG.
j) Los sustituyentes alrededor del anillo flexible de seis miembros podrían adoptar una serie de conformaciones. Escogeremos formas que minimicen interacciones estéricas adicionales para que podamos enfocarnos en las interacciones más básicas.
Tenga en cuenta que las aminas no suelen tener estereoquímica fija; el cuarto sustituyente en un nitrógeno amínico es un par solitario, que no ocupa una posición fija en el espacio. A diferencia de un carbono, el nitrógeno puede cambiar fácilmente de una estereoquímica a otra.
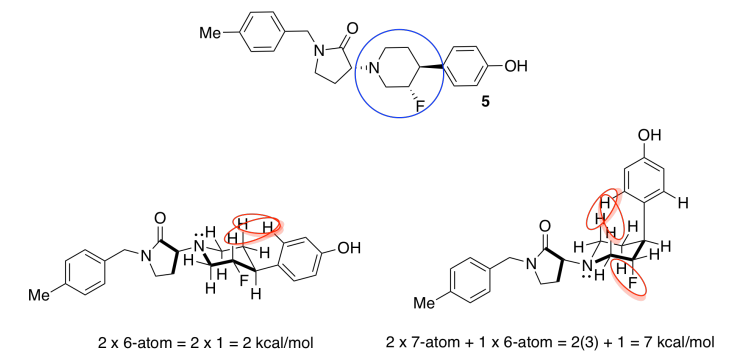
El de la izquierda, con más sustituyentes ecuatoriales y por lo tanto menos interacciones estéricas, es el más estable.
Ejercicio 6.14.2:
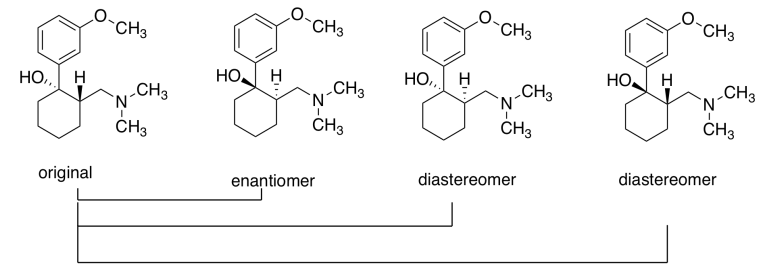
b) El original y su enantiómero; los dos primeros anteriores, de la izquierda.
c)
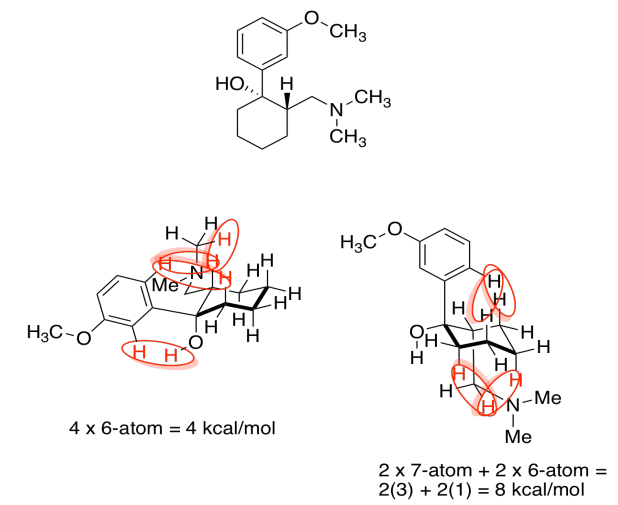
d) El de la izquierda, con ambos grupos de cepa ecuatorial y menos estérica, es más estable.
e) Si el de la izquierda está activo, se puede usar una dosis menor ya que pasará más tiempo en la forma activa y podrá unir más receptores. Si la menos estable, a la derecha, es la forma activa, se necesitará una dosis mayor porque solo una pequeña fracción de las moléculas estará lista para unirse al receptor en un momento dado.

