6.14: Problemas de aplicación
- Page ID
- 80689
Ejercicio\(\PageIndex{1}\)
Investigadores de Bristol-Myers-Squibb desarrollaron un nuevo antidepresivo (compuesto 2, a continuación). El fármaco se une a los receptores GluN2b, cerrando una señal del sistema nervioso central que se ha relacionado con la depresión. Desafortunadamente, los problemas cardíacos aparecieron como un efecto secundario del medicamento; el medicamento también se une a los receptores hERG, interfiriendo con los canales de iones potasio que son importantes para la función cardíaca.
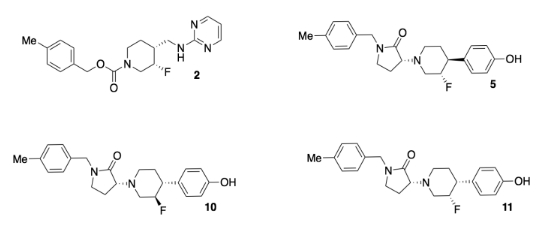
El equipo diseñó un nuevo conjunto de compuestos (incluyendo 5, 10, 11, arriba. Adaptado con permiso de Lawrence R. Marcin, Jayakumar Warrier, Srinivasan Thangatirupathy, et al, ACS Med. Chem. A lett. 2018, 9, 472−477. Derechos de autor 2018 Sociedad Americana de Química. Usado con permiso.).
Querían asegurarse de que los nuevos compuestos aún encajaran firmemente en el receptor GluN2b, que tiene aproximadamente 9-11 Ångstroms de largo.
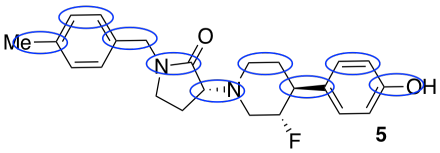
- En el compuesto 5, enlaces de círculo que corren aproximadamente paralelos a la longitud de la molécula (es decir, izquierda-derecha; no circunda ninguno que sea más arriba-abajo).
- Contar el número de estos seguidos. Si cada uno tiene aproximadamente 1 Å de largo, estime la longitud de la molécula.
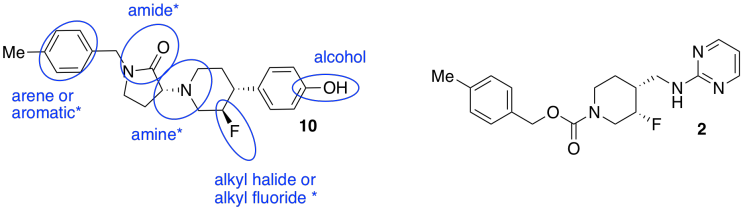
- Los grupos funcionales también son importantes porque controlan las interacciones con el receptor. En el compuesto 10, círculo y nombre cuatro de los grupos funcionales. Coloque un asterisco junto a cualquier grupo funcional que se encuentre en ambos compuestos 2 y 10.
- ¿Qué otro factor están mirando claramente los investigadores entre los compuestos 5, 10, 11? ¿Por qué los investigadores estarían interesados en ese factor?
- Declarar las relaciones entre los compuestos 5, 10, 11.
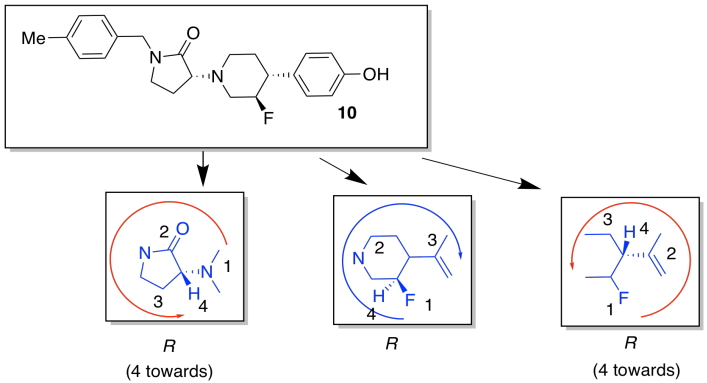
- Encuentra tres centros quirales en el compuesto 10. Dibuja suficiente de la estructura alrededor de cada centro quiral para que sea obvio cuál estás considerando. Clasificar la prioridad de los sustituyentes. Asigne la configuración (R o S) a cada centro.
- Los investigadores agregaron un anillo extra en los nuevos compuestos. Circula el nuevo anillo en el compuesto 10 que no tiene equivalente en el compuesto 2.
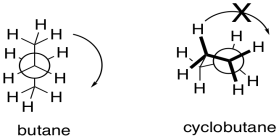
- Incorporaron este anillo porque estaban interesados en agregar “rigidez conformacional”. Para ilustrar esta idea, dibuje una proyección de Newman mirando hacia abajo
i) el enlace medio del butano ii) cualquier enlace de ciclobutano
Explique por qué un anillo introduce “rigidez conformacional” o “restricciones conformacionales”.
- ¿Por qué los investigadores estaban interesados en agregar rigidez conformacional?
- Solo uno de los anillos en el compuesto 5 puede adoptar conformaciones de silla (los otros son planos). Dibuja las dos sillas posibles. Asa cepas estéricas en cada conformador. Indicar qué conformador es más estable.
El compuesto 5 fue el candidato más prometedor; requirió la dosis más baja para GluN2b pero la dosis más alta para unirse a hERG.
- Respuesta a:
-
- Respuesta b:
-
cerca de 9 Å
- Respuesta c:
-
- Respuesta d:
-
Estereoquímica. Debido a que los receptores biológicos son generalmente proteínas que contienen sitios de unión únicos y quirales, esperan encontrar un estereoisómero que se ajuste al receptor GluN2b, pero no al receptor hERG.
- Respuesta e:
-
Estos compuestos son diastereómeros entre sí.
- Respuesta f:
-
- Respuesta g:
-
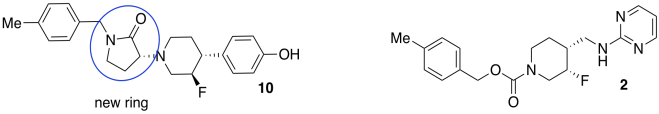
- Respuesta h:
-
El anillo introduce rigidez conformacional al evitar que la unión se someta a una rotación completa; se ata hacia atrás por la conexión en el otro lado del anillo.
- Respuesta i:
-
Estaban tratando de disminuir el número de posibles conformaciones, o formas, que el compuesto pudiera adoptar. De esa manera, sería menos probable que se uniera tanto en el receptor GluN2b como en el receptor hERG.
- Respuesta j:
-
Los sustituyentes alrededor del anillo flexible de seis miembros podrían adoptar una serie de conformaciones. Escogeremos formas que minimicen interacciones estéricas adicionales para que podamos enfocarnos en las interacciones más básicas.
Tenga en cuenta que las aminas no suelen tener estereoquímica fija; el cuarto sustituyente en un nitrógeno amínico es un par solitario, que no ocupa una posición fija en el espacio. A diferencia de un carbono, el nitrógeno puede cambiar fácilmente de una estereoquímica a otra.
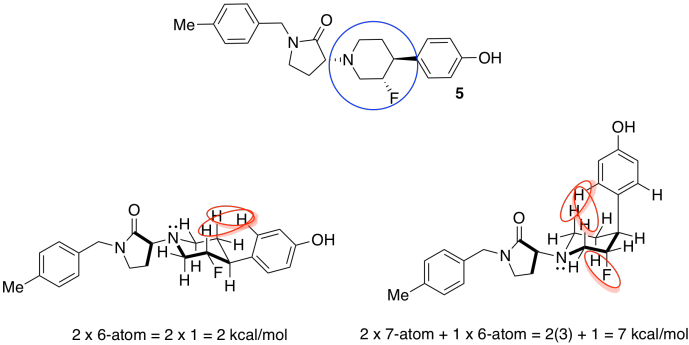
El de la izquierda, con más sustituyentes ecuatoriales y por lo tanto menos interacciones estéricas, es el más estable.
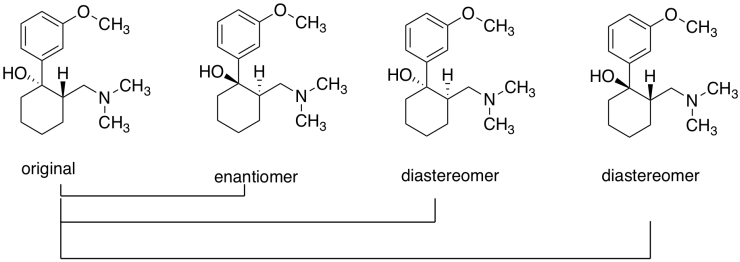
Ejercicio\(\PageIndex{2}\): Tramadol
El tramadol (abajo) es un analgésico opioide. Se utiliza para tratar el dolor crónico. Se administra como una mezcla racémica; cada compuesto se dirige a un receptor de dolor diferente.
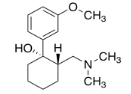
- Dibujar el enantiómero y cualquier diastereómero (s) de la molécula mostrada. Etiquetar las configuraciones en los centros quirales.
- Si la molécula original es parte de la mezcla terapéutica de tramadol, ¿qué otro compuesto también se administra?
- El compuesto original contiene un anillo que podría adoptar diferentes conformadores de silla. Dibujar ambos conformadores y evaluar la tensión estérica en cada uno.
- ¿Qué conformador es el más estable?
- El conformador más estable no es necesariamente el medicinalmente activo. ¿Cómo habría que ajustar la dosis si el conformador menos estable fuera realmente la forma activa?
- Respuesta a:
-
- Respuesta b:
-
El original y su enantiómero; los dos primeros anteriores, desde la izquierda.
- Respuesta c:
-

- Respuesta d:
-
El de la izquierda, con ambos grupos de cepa ecuatorial y menos estérica, es más estable.
- Respuesta e:
-
Si el de la izquierda está activo, se puede usar una dosis menor porque pasará más tiempo en la forma activa y podrá unir más receptores. Si la menos estable, a la derecha, es la forma activa, se necesitará una dosis mayor porque solo una pequeña fracción de las moléculas estará lista para unirse al receptor en un momento dado.

