7.3: Teoría cinético-molecular
- Page ID
- 80708
La temperatura es un indicador de cuánta energía hay disponible en los alrededores. Cuanto mayor sea la temperatura, más energía hay disponible y más rápido pueden ir las moléculas. Diferentes tipos de materia requieren diferentes cantidades de energía para moverse. Por eso algunos compuestos son gases a temperatura ambiente mientras que otros son sólidos.
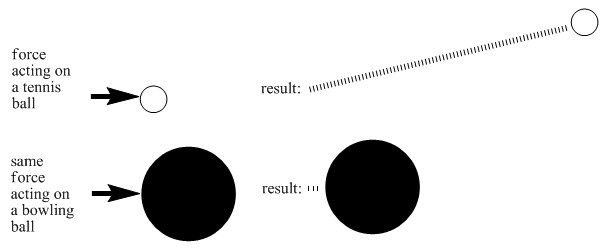
Estas diferencias son muchas las razones. Un factor es la masa de una molécula. Si golpeas una pelota de tenis con una raqueta de tenis, puedes estar seguro de que navegará por el aire, pero lo mismo podría no ser cierto si golpeas una pelota de boliche con una raqueta de tenis. Al poner la misma cantidad de energía en una pelota de tenis y una bola de boliche, harías que la pelota de tenis se mueva mucho más rápido que la bola de boliche. Los objetos más ligeros necesitan menos energía para alcanzar altas velocidades.
Para un ejemplo molecular, veamos los halógenos. Todos los halógenos elementales son moléculas diatómicas simples. Sus propiedades químicas tienen muchas similitudes, pero tienen puntos de ebullición y puntos de fusión muy diferentes. El yodo, con la mayor masa, es un sólido a temperatura ambiente, mientras que el flúor tiene la masa más baja y es un gas a prácticamente todas las temperaturas que probablemente encuentres en la Tierra.
| Nombre y fórmula | MW, g/mol | mp, ° C | bp, ° C |
| flúor, F 2 | 38.0 | -219.6 | -188.4 |
| cloro, Cl 2 | 70.9 | -100.98 | -34.6 |
| bromo, Br 2 | 159.8 | -7.2 | 58.8 |
| yodo, I 2 | 253.8 | 113.5 |
184.3 |
Claramente la masa de una molécula influye en su estado. ¿La masa de una molécula por sí sola nos permite predecir su comportamiento? No. Un factor mucho más importante implica otra diferencia entre gases, líquidos y sólidos: la atracción entre moléculas. Las moléculas en los sólidos no solo están sentadas quietas; están sentadas quietas juntas. Conseguir que un cristal de yodo se evapore requiere alejar a las moléculas unas de otras, y superar esta atracción entre ellas.
Hay muchos tipos diferentes de atracciones intermoleculares. Los halógenos de la tabla anterior se aferran entre sí a través del tipo más débil: interacciones de dispersión de Londres. Comenzaremos por mirar esas interacciones, y luego pasaremos a tipos más fuertes, como las interacciones dipolares y los enlaces de hidrógeno.
Ejercicio\(\PageIndex{1}\)
Con base en los datos de la tabla anterior, ¿qué predicería para el punto de fusión y punto de ebullición del nitrógeno, N 2, y oxígeno, O 2?
- Contestar
-
Por lo que podemos decir de estos datos, el punto de fusión del nitrógeno y el oxígeno estaría en algún lugar alrededor de -220 o C, mientras que el punto de ebullición estaría alrededor de -180 o C. Esperaríamos que estos números fueran similares al flúor, que tiene una masa similar. De hecho, los puntos de fusión y ebullición del oxígeno son aproximadamente -219 o C y -183 o C, respectivamente. Los puntos de fusión y ebullición del nitrógeno son aproximadamente -210 o C y -196 o C, respectivamente.

