7.4: Interacciones en Londres
- Page ID
- 80724
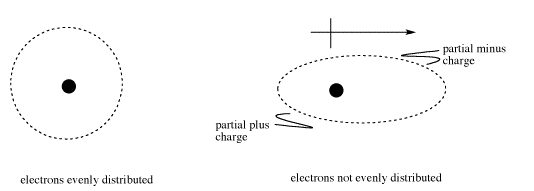
Todas las moléculas pueden experimentar interacciones londinenses o fuerzas de dispersión (a veces llamadas interacciones de van der Waals, aunque muchas personas usan este término para describir cualquier tipo de atracción intermolecular). Estas interacciones son atracciones electrostáticas temporales causadas por el movimiento aleatorio de electrones alrededor de una molécula. Si en un momento se encuentran más electrones en un lado de la molécula que en el otro, entonces la molécula desarrollará un dipolo.
Un dipolo es una separación de carga. Si los electrones pasan a un lado de la molécula, ese extremo de la molécula se carga negativamente, porque los electrones son negativos. El otro extremo de la molécula, sin embargo, se carga positivamente, debido a que los electrones cargados negativamente que deberían estar equilibrando la carga positiva del núcleo se han desviado hacia el otro extremo de la molécula. Simbolizamos esta separación de carga con una flecha dipolo. Un extremo de la flecha parece un signo más; ese es el final más positivo. El extremo puntiforme de la flecha representa el extremo negativo.
Este dipolo es transitorio, es decir, no dura mucho tiempo. Sin embargo, en su corta vida útil en realidad podría inducir otro dipolo en una molécula vecina. Los electrones reunidos en un lado de una molécula podrían repeler a los electrones en el lado cercano de la siguiente molécula. Esta situación dejaría el extremo más negativo de una molécula junto al extremo más positivo de su vecino, y resultaría una débil atracción.
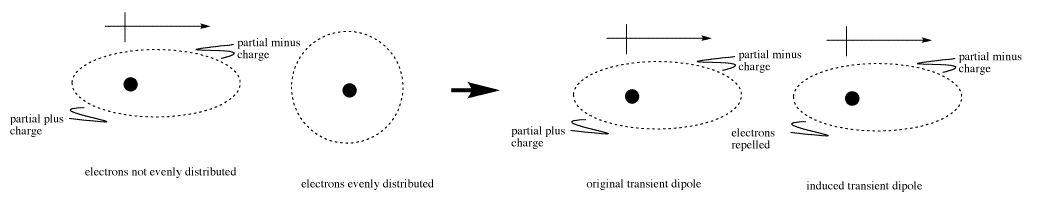
En la mayoría de las moléculas, y especialmente las relativamente no polares, este tipo de interacciones duran pequeñas fracciones de segundos. Eso significa que si las moléculas dependen completamente de las interacciones de Londres para mantenerse unidas, probablemente no se peguen muy bien.
Sin embargo, hay un par de factores que pueden hacer que estas pequeñas interacciones se sumen hasta que sean bastante significativas. Primero, las moléculas con muchos electrones poco retenidos experimentarían más interacciones en Londres que las moléculas con menos electrones más apretados. Eso se debe a que cuantos más electrones haya, y cuanto más libremente se muevan, más probabilidades habrá de crear ese dipolo transitorio inicial. Este factor es bastante significativo a la hora de comparar los halógenos, ya que el flúor tiene nueve electrones apretados mientras que el yodo tiene cincuenta y tres, y la mayoría de ellos están tan lejos del núcleo que son difíciles de rastrear.
Además, este tipo de atracción no funciona muy bien entre dos moléculas que están muy alejadas entre sí. Debido a que es una atracción tan débil, funciona mejor cuando las dos moléculas están muy cerca una de la otra. Cuanto más contacto haya entre las superficies de las dos moléculas, más probable es que una molécula pueda inducir un dipolo en su vecina, y más fuerte será la atracción.
Todo es cuestión de superficie. Cuanto más contacto superficial entre dos moléculas o dos materiales, más probabilidades hay de que interactúen entre sí. De hecho, este tipo de fenómenos puede llevar a algunos resultados sorprendentes si se llevan al extremo. Muchos investigadores creen que la capacidad de los geckos para caminar sobre paredes y techos, aunque la superficie sea muy lisa, se debe enteramente a las fuerzas de van der Waals. Millones de fibras diminutas (o setas) cubren los fondos de las patas de lagarto, y cada una de estas fibras está cubierta por cientos de almohadillas más pequeñas (o espátulas). Estas estructuras aseguran que haya suficiente contacto superficial para muchas, muchas interacciones débiles para sumar un agarre fuerte. Algunas empresas incluso están tratando de usar esta idea para hacer adhesivos muy fuertes pero removibles basados en este modelo gecko.
Consideremos ahora la diferencia entre las fuerzas atractivas que se encontrarían en dos formas diferentes de moléculas. En un caso, las moléculas son pequeñas y redondas, como pelotas de ping-pong. En el otro caso, las moléculas son largas, y lineales, como cintas de espagueti o lasaña.
Puedes arreglar las pelotas de ping pong de la forma que más te guste (sin machacarlas de plano), y nunca podrán hacer más que apenas tocar a sus vecinos.
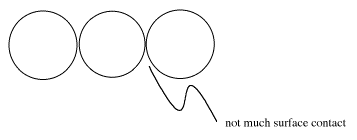
Los fideos de lasaña se apilan muy fácilmente uno encima del otro, y tienen mucho contacto con los otros fideos de lasaña.

Si las interacciones de Londres se basan en dipolos temporales que se inducen solo si las moléculas pueden acercarse mucho entre sí; sería mejor que las dos moléculas casi pudieran tocarse entre sí.
Este factor resulta de la ley física de que las fuerzas eléctricas caen muy rápidamente con el aumento de la distancia. Cuanto más alejadas estén las moléculas, menos fuertemente podrán tener un efecto unas sobre otras.
Entonces, las moléculas largas en forma de banda, que tienen más área de superficie en contacto con sus vecinos, tienen más probabilidades de inducir dipolos en sus vecinos, y es más probable que se mantengan juntas. Las moléculas esféricas, con menor superficie en contacto, se atraerán entre sí más débilmente.
¿Qué tipo de moléculas tienen forma de pelotas de ping pong y espaguetis? Dos moléculas muy similares, ambas con la fórmula C 5 H 12, pueden servir como ejemplos.

El pentano normal, o n-pentano, es una molécula en la que los cinco carbonos están dispuestos en una cadena, con los hidrógenos completando la valencia de cada carbono. El neopentano, o 2,2-dimetilpropano, es una molécula en la que un carbono central está unido a cada uno de los otros cuatro carbonos, y cada uno de esos cuatro carbonos tiene tres hidrógenos en él. Sobre el papel, uno podría imaginar que el pentano tiene forma de espagueti, pero el neopentano se parece más a una cruz. Es necesario mirar un modelo que llene espacio para ver que el neopentano es muy parecido a una pelota.
Resulta que el pentano tiene un punto de ebullición de 35 o C, mientras que el neopentano, con exactamente la misma fórmula molecular, tiene un punto de ebullición de -9 o C. Eso significa que, a temperatura ambiente cómoda, el pentano es un líquido, mientras que el neopentano es un gas incluso en un día bastante frío. Las moléculas de pentano se pegan más juntas porque hay más contacto entre ellas; las moléculas de neopentano no, y cada una sigue su propio camino, formando un gas.
El pentano y el neopentano son isómeros. Tienen la misma fórmula pero diferentes estructuras. Isómeros es del griego, que significa “mismas cosas”, refiriéndose a su contenido idéntico. Sin embargo, los isómeros a menudo tienen propiedades físicas y biológicas muy diferentes.
Ejercicio\(\PageIndex{1}\)
Compara las fuerzas de Londres en los siguientes pares de moléculas y predice los puntos de fusión relativos de los dos compuestos.
a) CH 3 (CH 2) 6 CH 3 y CH 3 (CH 2) 100 CH 3
b) CH 3 (CH 2) 6 CH 3 y CH 3 (CH 2) 3 C (CH 3) 3
c) CH 3 Br y CH 3 Cl
- Respuesta a:
-
Una cadena de 8 carbonos de largo tendría interacciones de Londres mucho más bajas que una cadena de 102 átomos de largo. Cuanto mayor sea el contacto entre las moléculas, mayor será la probabilidad de atracciones débiles debido a pequeñas cargas derivadas del movimiento aleatorio de electrones. La molécula con la cadena más larga tendría el punto de fusión más alto, porque habría que agregar más energía para superar esos atractivos y hacer que las moléculas se muevan.
- Respuesta b:
-
La primera cadena es más lineal mientras que la segunda cadena es más ramificada. Las moléculas más lineales se empaquetarán más fácilmente, permitiendo un mayor contacto superficial para aumentar las interacciones de Londres. La cadena más recta tendría un punto de fusión más alto.
- Respuesta c:
-
El bromometano tiene muchos más electrones que el clorometano. Basándonos solo en las interacciones de Londres, esperaríamos que el bromometano tenga un punto de fusión más alto. De hecho, el punto de fusión del bromometano es de aproximadamente -94 o C, en comparación con aproximadamente -97 o C para el clorometano; debe haber otro factor que compense la diferencia en números de electrones y haga que estos valores sean tan cercanos.
Ejercicio\(\PageIndex{2}\)
Predecir los puntos de ebullición relativos de 3,4-dibromohexano y 3,3-dimetilhexano.
- Contestar
-
Debido a la gran cantidad de electrones en el bromo, esperaríamos un punto de ebullición más alto en 3,4-dibromohexano.
Ejercicio\(\PageIndex{3}\)
¿Qué predecirías sobre los puntos de fusión relativos del éter dibencílico y el éter bis (ciclohexilmetílico)? (Nota: “bis” se usa a menudo en lugar de “di” como prefijo para grupos más complicados).
- Contestar
-
Recuerde que el bencilo se refiere al grupo C 6 H 5 CH 2 (abajo a la derecha); ciclohexilmetilo sugiere el C 6 H 12 CH 2 superficialmente similar (abajo a la izquierda).

El grupo bencilo contiene carbonos planos trigonales, mientras que el grupo ciclohexilmetilo contiene solo carbonos tetraédricos. Los grupos bencilo, al ser más planos, podrían empaquetarse más fácilmente e interactuar más fuertemente. Esperaríamos que el éter dibencílico tenga un punto de fusión más alto.

