7.15: Soluciones a problemas seleccionados
- Page ID
- 80722
Ejercicio 7.1.1:
Una diferencia entre el agua y estas otras moléculas es que el agua es polar: existe una diferencia significativa de electronegatividad entre el oxígeno y el hidrógeno. Las cargas en una molécula de agua pueden estar interactuando con cargas en otras moléculas de agua.
Ejercicio 7.2.1:
Ejercicio 7.3.1:
Por lo que podemos decir de estos datos, el punto de fusión del nitrógeno y el oxígeno estaría en algún lugar alrededor de -220°C, mientras que el punto de ebullición sería de alrededor de -180°C, esperaríamos que estos números fueran similares al flúor, que tiene una masa similar. De hecho, los puntos de fusión y ebullición del oxígeno son aproximadamente -219°C y -183°C, respectivamente. Los puntos de fusión y ebullición del nitrógeno son aproximadamente -210°C y -196°C, respectivamente.
Ejercicio 7.4.1:
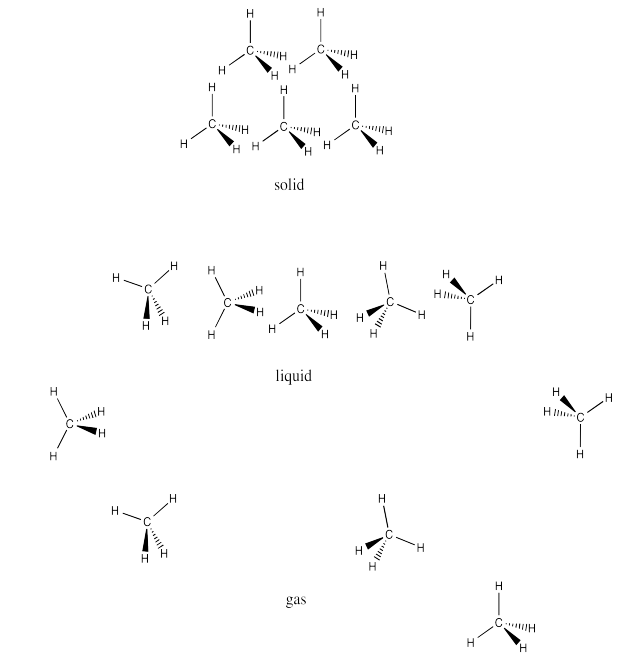
- Una cadena de 8 carbonos de largo tendría interacciones de Londres mucho más bajas que una cadena de 102 átomos de largo. Cuanto mayor sea el contacto entre las moléculas, mayor será la probabilidad de atracciones débiles debido a pequeñas cargas derivadas del movimiento aleatorio de electrones. La molécula con la cadena más larga tendría el punto de fusión más alto, porque habría que agregar más energía para superar esos atractivos y hacer que las moléculas se muevan.
- La primera cadena es más lineal mientras que la segunda cadena es más ramificada. Las moléculas más lineales se empaquetarán más fácilmente, permitiendo un mayor contacto superficial para aumentar las interacciones de Londres. La cadena más recta tendría un punto de fusión más alto.
- El bromometano tiene muchos más electrones que el clorometano. Basándonos solo en las interacciones de Londres, esperaríamos que el bromometano tenga un punto de fusión más alto. De hecho, el punto de fusión del bromometano es de aproximadamente -94°C, en comparación con aproximadamente -97°C para el clorometano; debe haber otro factor que compense la diferencia en números de electrones y haga que estos valores sean tan cercanos.
Ejercicio 7.4.2:
Debido a la gran cantidad de electrones en el bromo, esperaríamos un punto de ebullición más alto en 3,4-dibromohexano.
Ejercicio 7.4.3:
Recuerde que el bencilo se refiere al grupo C 6 H 5 CH 2 (abajo a la derecha); ciclohexilmetilo sugiere el C 6 H 12 CH 2 superficialmente similar (abajo a la izquierda).
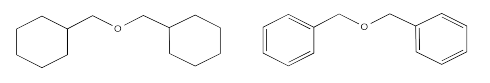
El grupo bencilo contiene carbonos planos trigonales, mientras que el grupo ciclohexilmetilo contiene solo carbonos tetraédricos. Los grupos bencilo, al ser más planos, podrían empaquetarse más fácilmente e interactuar más fuertemente. Esperaríamos que el éter dibencílico tenga un punto de fusión más alto.
Ejercicio 7.5.1:
Todos estos compuestos contienen muchos enlaces C-C y C-H no polares, que no tendrían dipolos apreciables. Sin embargo, en cada par, hay un compuesto que contiene más enlaces polares también: C-Cl, C-N y C-O.
Ejercicio 7.5.2:
Los dipolos son vectores. Si tenemos dos enlaces polares, se sumarán usando la adición de vectores. Cualquier vector puede mostrarse como la suma de otros dos vectores. Abajo, la flecha roja apunta hacia abajo y hacia la izquierda. ¿Qué tan abajo y qué tan lejos a la izquierda? Podemos mostrar hasta qué punto usando las flechas azules. La flecha azul hacia abajo y la flecha azul a la izquierda se suman para dar la flecha roja que baja y hacia la izquierda.

En diclorometano, hay dos enlaces polares. Ambos enlaces están polarizados hacia el cloro más electronegativo. Como se dibuja a continuación, un enlace tiene un dipolo recto a la derecha. El otro enlace tiene un dipolo que baja y hacia la izquierda. Si la molécula tiene un dipolo general, con un extremo positivo de toda la molécula y un extremo negativo de toda la molécula, ¿qué extremo sería positivo y cuál sería negativo?

Parece razonable que el final positivo estaría en algún lugar sobre el lado del hidrógeno y el extremo negativo estaría en algún lugar sobre el lado del cloro. El dipolo general, a diferencia de los dipolos de enlace individuales, apuntaría en algún lugar en la dirección de la flecha azul discontinua. Pero, ¿qué tan grande sería? Seguramente es más grande que cualquiera de los dos dipolos individuales, porque se están sumando, ¿verdad?
Echemos una mirada muy cualitativa. La primera flecha roja está justo a la derecha. Romperemos la segunda flecha en una flecha más pequeña hacia abajo y una flecha aún más pequeña hacia la izquierda. La suma de las flechas izquierda/derecha es una flecha muy pequeña a la derecha.
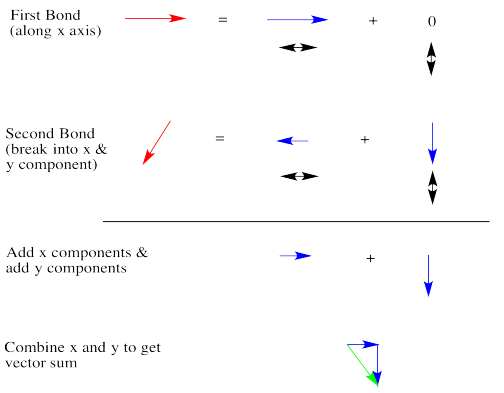
La suma de las flechas arriba/abajo es solo una pequeña flecha hacia abajo. En general, la suma es una flecha verde que va hacia abajo y hacia la derecha. El resultado no parece realmente más grande que un dipolo de enlace individual.
Ejercicio 7.5.3:
A pesar de los momentos dipolares relativamente similares, el punto de ebullición del diclorometano es mucho mayor que el del clorometano. La diferencia probablemente radica en la masa mucho mayor de diclorometano.
Ejercicio 7.5.4:
En cada caso, el de la derecha tiene un dipolo más grande y un punto de fusión más alto.
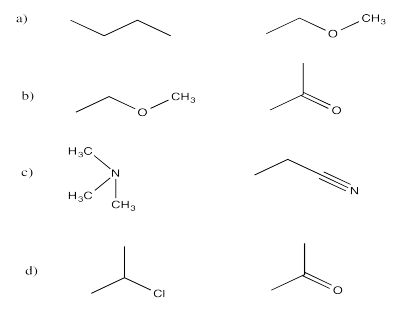
Ejercicio 7.6.1:
Solo la etilamina y el ácido etanoico tienen los enlaces N-H u O-H que son lo suficientemente polares para el enlace de hidrógeno.
Ejercicio 7.6.2:
hexilamina > dipropilamina > trietilamina
El que tenga mayor potencial de enlaces de hidrógeno tendrá el punto de fusión más alto.
Ejercicio 7.6.3:
Ejercicio 7.8.1:
El enlace de hidrógeno entre las moléculas de 2-propanol es una interacción más fuerte y es más difícil de superar que las interacciones dipolo-dipolo entre moléculas de 2-propanona. Por lo tanto, las moléculas de 2-propanona pueden escapar más fácilmente a la fase de vapor.
Ejercicio 7.8.2:
Hay enlaces de hidrógeno entre las moléculas de N-metiletilamina, pero no entre las moléculas de trietilamina, las cuales se mantienen unidas por dipolos relativamente débiles. Las moléculas de trimetilamina no se mantienen juntas tan fuertemente como las moléculas de N-metiletilamina, que por lo tanto se empaquetan más densamente. Por otro lado, la n-propilamina contiene dos enlaces N-H, en comparación con solo uno en N-metiletilamina. En consecuencia, la n-propilamina tiene una mayor propensión a formar enlaces de hidrógeno, y se empaca aún más densley que la N-metiletilamina..
Ejercicio 7.8.3:
La temperatura es una medida de cuánta energía está disponible en el ambiente. A medida que aumenta la temperatura, las moléculas obtienen más energía y transfieren esa energía a una variedad de movimientos moleculares. A medida que se mueven más, son menos capaces de permanecer densamente empaquetados. La densidad disminuye a medida que sube la temperatura. Por el contrario, las cosas tienden a encogerse a medida que se enfrían, porque las moléculas se ralentizan y comienzan a empacar más Se vuelven más densos.
Ejercicio 7.8.4:
- El ácido acético posee capacidad de enlace de hidrógeno, mientras que la 2-propanona tiene la capacidad de formar solo interacciones dipolo-dipolo. Por lo tanto, las moléculas de 2-propanona no se mantienen en la fase líquida tan fuertemente como el ácido acético, y el primer compuesto tiene una presión de vapor más alta.
- El enlace C=O del acetato de etilo tiene un dipolo sustancial, pero los dipolos en éter no suman mucho; son más pequeños para empezar y cancelan parcialmente vía adición vectorial. Las moléculas de éter pueden escapar del líquido más fácilmente, lo que resulta en una mayor presión de vapor.
- Ambas moléculas están limitadas a interacciones de dispersión relativamente débiles en Londres. Debido a que el heptano forma una cadena más larga que el pentano, habrá una interacción ligeramente mayor entre las moléculas de heptano que entre las moléculas de pentano. Por lo tanto, el pentano tiene la mayor presión de vapor.
Ejercicio 7.8.5:
- El enlace C=O 2-butanona tiene un dipolo sustancial, pero los dipolos en éter no suman mucho; son más pequeños para empezar y cancelan parcialmente vía adición vectorial. Las moléculas de 2-butanona se adhieren más fuertemente, lo que resulta en una mayor viscosidad.
- Ambas moléculas están limitadas a interacciones de dispersión relativamente débiles en Londres. Debido a que el decano forma una cadena más larga que el hexano, habrá una interacción ligeramente mayor entre las moléculas de decano que entre las moléculas de hexano. El decano tiene así la mayor viscosidad. Posteriormente, si estudias macromoléculas, verás que en cadenas muy, muy largas, el “enredo” se convierte también en factor. Así como su nombre lo indica, cadenas realmente largas se enredan juntas y tienen dificultades para pasar unas de otras; por eso materiales como el aceite de cocina y el aceite de motor son tan viscosos.
- El 1-butanol puede unirse por hidrógeno, pero el éter solo tiene interacciones dipolo-dipolo débiles. El 1-butanol es por lo tanto más viscoso.
Ejercicio 7.8.6:
- El 1-butanol puede unirse por hidrógeno, pero el éter solo tiene interacciones dipolo-dipolo débiles. Por lo tanto, el 1-butanol tiene mayor tensión superficial.
- El 1-butanol puede unirse por hidrógeno, pero el 1,3-butanodiol tiene dos grupos OH y puede formar incluso más enlaces de hidrógeno que el 1-butanol. Por lo tanto, el 1,3-butanodiol tiene mayor tensión superficial.
- La formamida tiene enlaces N-H y por lo tanto es capaz de formar enlaces de hidrógeno. A pesar de tener un dipolo bastante grande y maldito, el nitrometano realmente no puede unir el hidrógeno. Por lo tanto, la formamida tiene mayor tensión superficial.
Ejercicio 7.8.7:
- 2-propenol. Tiene capacidad de enlace de hidrógeno pero el propanal no.
- ácido heptanoico. Tiene capacidad de enlace de hidrógeno pero el pentanoato de etilo no.
- 1-hexen-3-ona. Su dipolo es mayor que el del éter, porque proviene de un enlace C=O en lugar de enlaces C-O.
Ejercicio 7.8.8:
- 2-butanona. Su dipolo es mayor que el del éter, porque proviene de un enlace C=O en lugar de enlaces C-O.
- octano. Tiene mayores interacciones de dispersión en Londres que el pentano debido a la mayor área de contacto superficial en octano.
- 1,3-butanodiol. Tiene enlaces de hidrógeno pero el DME no.
Ejercicio 7.8.9:
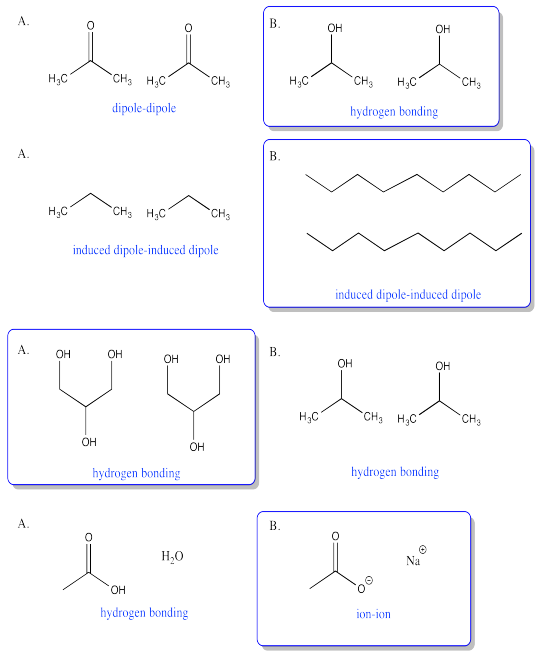
Ejercicio 6.9.1:
Enlace de hidrógeno.
Ejercicio 6.9.2:
a) interacciones dipolo b) interacciones Londres c) interacciones dipolo d) enlaces de hidrógeno
Ejercicio 6.9.3:
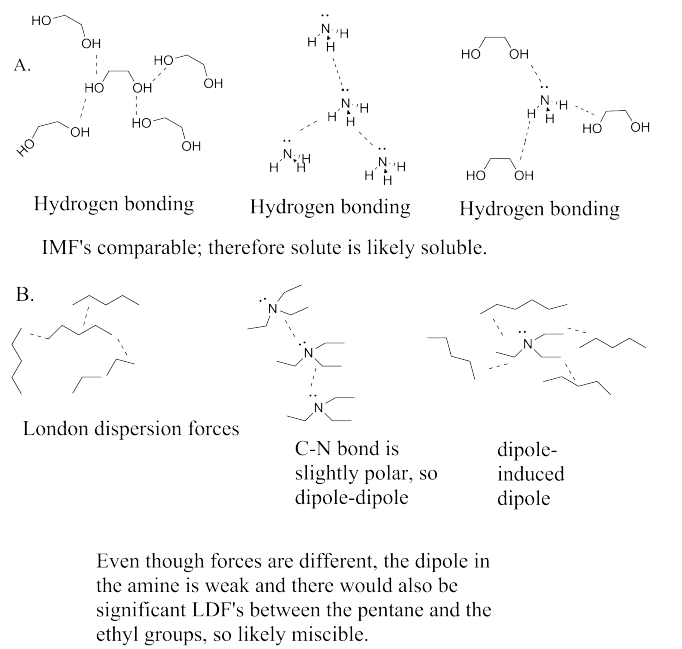
Las moléculas de agua interactúan entre sí principalmente a través de enlaces de hidrógeno, mientras que las moléculas de octano interactúan entre sí a través de las interacciones El principal problema aquí es el fuerte enlace de hidrógeno entre las moléculas de agua. Todas las moléculas, en principio, podrían interactuar entre sí a través de las interacciones de Londres. Sin embargo, si se introdujeran moléculas de octano entre las moléculas de agua, ocuparían espacio. Algunas de las moléculas de agua ya no podrían acercarse lo suficiente entre sí al enlace de hidrógeno. La pérdida de esa interacción tan estabilizadora sería demasiado costosa.
Ejercicio 6.9.4:
Este problema es similar al anterior, pero en este caso la atracción entre los dipolos fuertes de los grupos nitrilo sería demasiado para superar.
Ejercicio 6.9.5:
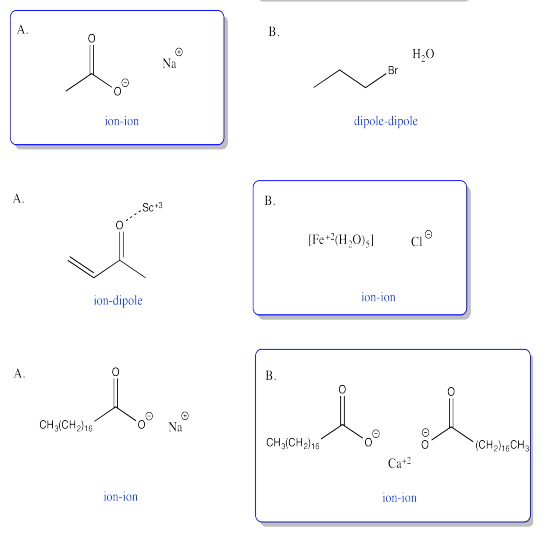
Ejercicio 7.9.6:
a) dipolo/dipolo inducido b) dipolo/dipolo c) enlace de hidrógeno d) dipolo/dipolo inducido
Ejercicio 7.10.1
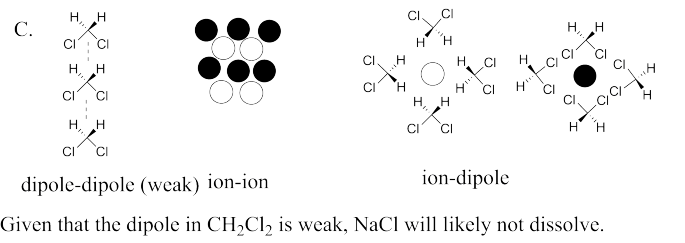
El orden previsto, de más soluble a menor, sería LiCl > MgSO 4 > AlPO 4 porque los iones aumentan en carga de 1+/- a 2+/- a 3+/-
Ejercicio 7.10.2:
El orden previsto, de más soluble a menor, sería dimetilsulfóxido > acetonitrilo > piridina > diclorometano > trietilamina.
Ejercicio 7.11.1:
a) aceptor de enlace H b) aceptor de enlace H c) enlace H completo d) aceptor de enlace H e) enlace H completo f) ninguno
Ejercicio 7.12.1:
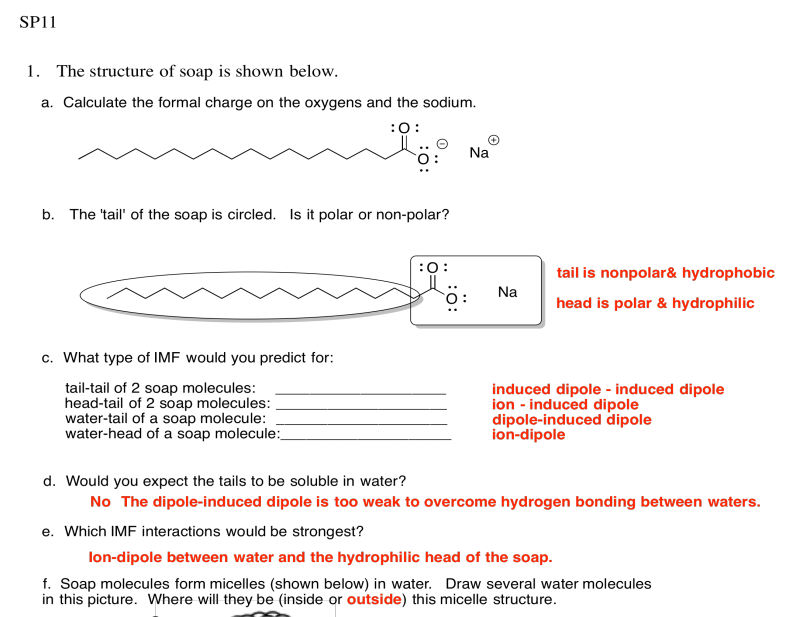

Ejercicio 7.13.1:
Tenga en cuenta que el último ejemplo en realidad se encuentra en el ARN, no en el ADN. El ARN se encuentra como una sola hebra, en lugar de un par de hebras. Se une hidrógeno consigo mismo en una forma particular, no muy diferente de la forma en que una proteína adopta una forma específica.
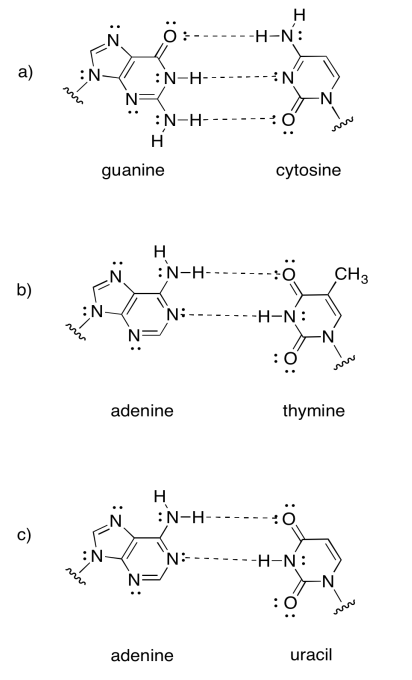
Ejercicio 7.13.2:
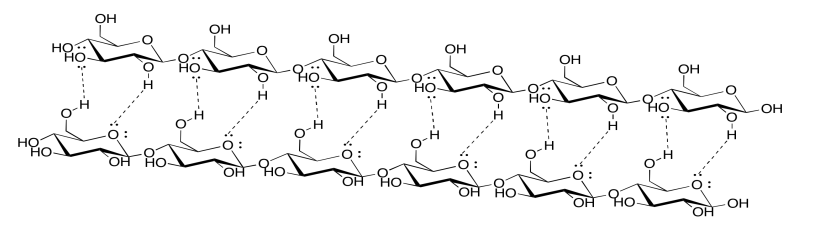
Ejercicio 7.13.3:
Aunque la lignina es capaz de algunos enlaces de hidrógeno, no puede hacer casi tantos enlaces de hidrógeno como la celulosa. El papel que contiene lignina sería mucho más débil, y más probable que se rasgara o se desmorone cuando se moje, porque las moléculas de celulosa no podrían unirse entre sí tan fuertemente con la lignina mezclada. De hecho, las bolsas de papel marrón de la tienda de abarrotes están hechas de kraft, a la que no se le ha quitado la lignina; son mucho más débiles que la mayoría del papel, sobre todo si se mojan.
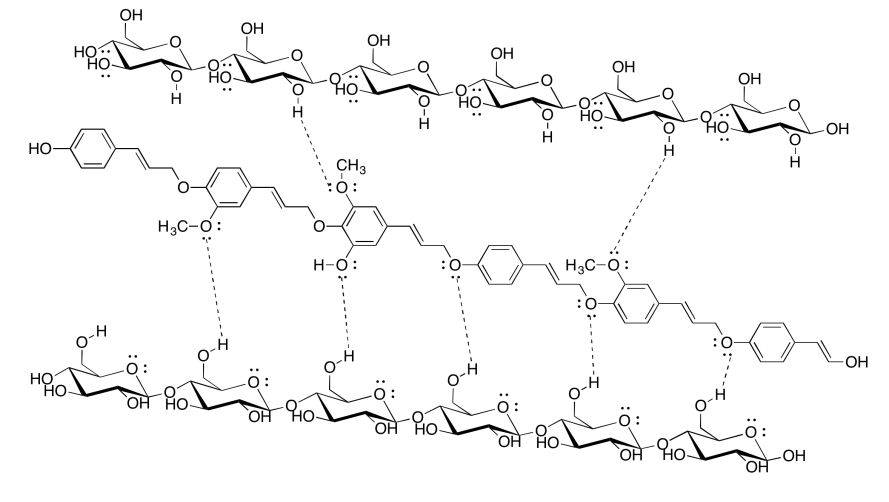
Ejercicio 7.13.4:
La atracción intermolecular dominante aquí es solo la dispersión de Londres (o solo dipolo inducido). La dispersión londinense es muy débil, por lo que depende fuertemente de mucha área de contacto entre las moléculas para construir una interacción apreciable. Los triglicéridos que contienen ácido esteárico podrán empacar mucho más estrechamente que los que contienen ácido oleico más mezclados, por lo que tendrán mucho más contacto superficial y atracciones mucho más fuertes. se mantendrán unidos en un sólido.
Ejercicio 7.13.5:
a) hélice alfa b) lámina beta c) hélice alfa d) lámina beta e) lámina beta
f) hélice alfa g) hélice alfa h) lámina beta i) hélice alfa j) hélice alfa
Ejercicio 7.14.1:
a)
| agua | agua | |
| iónico | no | no |
| Aceptador H-bond | si | si |
| Donante de enlace H | si | si |
| dipolo | si | si |
| dipolo inducido | si | si |
El hidrógeno del agua se une con el agua.
b)
| goof | goof | |
| iónico | no | no |
| Aceptador H-bond | no | no |
| Donante de enlace H | no | no |
| dipolo | no | no |
| dipolo inducido | si | si |
Las formas de error indujeron interacciones dipolo/dipolo inducidas (fuerzas de dispersión de Londres) consigo mismo.
c)
| goof | grasa | |
| iónico | no | no |
| Aceptador H-bond | no | no |
| Donante de enlace H | no | no |
| dipolo | no | no |
| dipolo inducido | si | si |
Las formas de goof-off indujeron interacciones dipolo/dipolo inducidas (fuerzas de dispersión de Londres) con grasa.
d)
| grasa | agua | |
| iónico | no | no |
| Aceptador H-bond | no | si |
| Donante de enlace H | no | si |
| dipolo | no | si |
| dipolo inducido | si | si |
El agua forma interacciones dipolo/dipolo inducido con la grasa.
La clave de por qué funciona la tontería es que se involucra en las mismas interacciones de dispersión londinense con la grasa que la grasa misma. El agua es buena para resolver muchas cosas, pero no grasa. Eso se debe principalmente a que el agua tendría que renunciar a algunos de los fuertes enlaces de hidrógeno con otras moléculas de agua para encajar las moléculas de grasa entre las moléculas de agua.
Ejercicio 7.14.2:
a)
| octano | octano | |
| iónico | no | no |
| Aceptador H-bond | no | no |
| Donante de enlace H | no | no |
| dipolo | no | no |
| dipolo inducido | si | si |
Eso va a ser inducidas interacciones dipolo inducidas por dipolo en octano.
b)
| isopropanol | isopropanol | |
| iónico | no | no |
| Aceptador H-bond | si | si |
| Donante de enlace H | si | si |
| dipolo | si | si |
| dipolo inducido | si | si |
Enlace de hidrógeno en isopropanol.
c)
i)
| isopropanol | agua | |
| iónico | no | no |
| Aceptador H-bond | si | si |
| Donante de enlace H | si | si |
| dipolo | si | si |
| dipolo inducido | si | si |
Enlace de hidrógeno entre isopropanol y agua.
ii)
| octano | isopropanol | |
| iónico | no | no |
| Aceptador H-bond | no | si |
| Donante de enlace H | no | si |
| dipolo | no | si |
| dipolo inducido | si | si |
Interacciones dipolares inducidas por dipolo entre octano e isopropanol.
d)
e) No, el etanol debe hacer lo mismo que el HEET.
Ejercicio 7.14.3:
a)
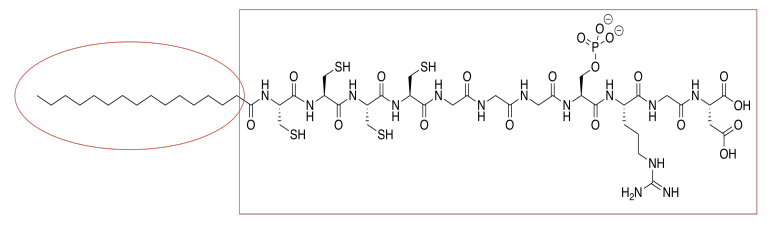
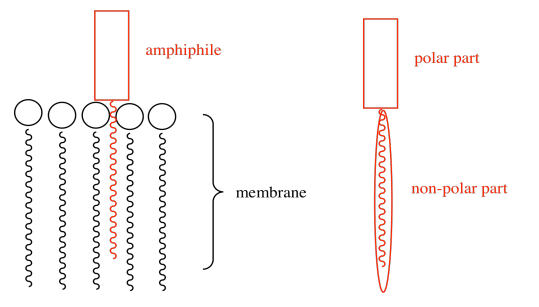
b) El anfífilo se inserta en la membrana celular. Dibuja una caricatura de una porción de una membrana celular. Agrega una caricatura del anfífilo sintético a la membrana. ¿Qué es el FMI a través del cual interactúa con la membrana?
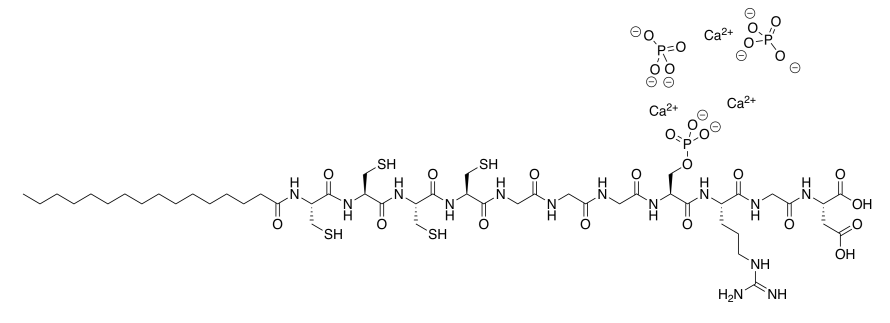
c) Ca 2+ (dos átomos desde el borde izquierdo).
d) PO 4 3- porque\( 3 \times (2^{+}) + 2 \times (3^{-}) = 0\); carga neutra en general.
e) Estas altas cargas (2 + /3 -) se unen mucho más fuertemente que las cargas bajas (1 + /1 -) en cloruro de sodio.
f)
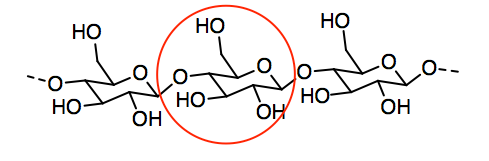
Ejercicio 7.14.4:
a)
b)

c)
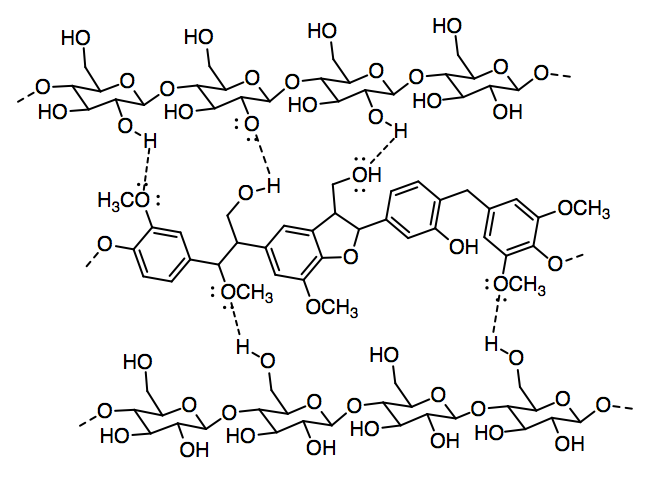
d)
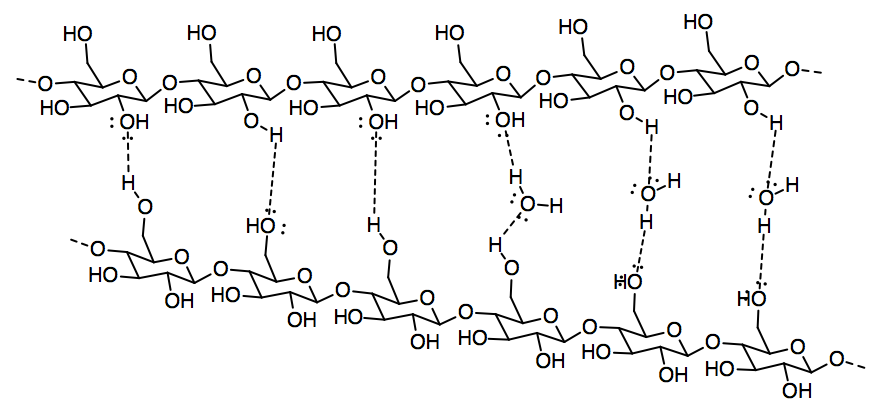
e) El grupo ácido carboxílico proporciona sitios para enlaces de hidrógeno, incluyendo tanto un donador de enlace de hidrógeno en el grupo OH como un aceptor de enlace de hidrógeno adicional en el grupo C=O.
f) Introduce una parte “hidrofóbica” en la que la mayor fuerza intermolecular con el agua sería una interacción dipolo inducida por dipolo. Si las moléculas de agua se mantienen solas, podrán maximizar la cantidad de enlaces de hidrógeno que pueden hacer entre sí. Es mejor que el agua no se mezcle con el papel.
g) Todas las proteínas tienen cadenas principales polares formadas por sus enlaces amida o enlaces peptídicos (-NH-C=O). Estas porciones pueden formar enlaces de hidrógeno con la celulosa en el papel. Además, puede haber cadenas laterales polares como serina o treonina, por ejemplo, que contienen grupos OH que pueden formar enlaces de hidrógeno con el papel.
h) Los residuos hidrófobos agregarían resistencia al agua, por la misma razón que la parte hidrófoba del ácido abiético en la colofonia.
i) Ti 4+ tendría la misma configuración electrónica que el argón. O 2- tendría la misma configuración electrónica que el neón.
j) La fórmula es TiO 2, de manera que se equilibran las cargas positivas (4 +) y las cargas negativas (2 x 2 - = 4 -).
k) Los cargos 4 + y 2 - son bastante grandes. Los iones altamente cargados son difíciles de disolver, porque la atracción ión-dipolo del ion con el agua no puede competir con las muy fuertes atracciones iónicas entre los iones.
l) Dipolo iónico. Se pueden imaginar los átomos de oxígeno parcialmente negativos de la celulosa interactuando con los cationes de titanio y los hidrógenos parcialmente positivos de los grupos OH en la celulosa interactuando con los aniones óxido.
m) Ti: un átomo completo en el centro y ocho en las esquinas, por lo que 1 + 8x (1/8) = 2 átomos de Ti.
O: dos átomos completos (hacia los extremos izquierdo y derecho de la imagen) más cuatro medios átomos (en las caras superior e inferior de la celda), por lo que 2 + 4x (1/2) = 4 átomos de O.
relación: 1 Ti: 2 O o TiO 2 en notación de fórmula.
n) Los Ti se empaquetan en una celda que se asemeja a una celda cúbica centrada en el cuerpo. No obstante, la celda no es realmente cúbica, porque está un poco estirada. A veces llamamos a esa forma “tetragonal”.
o) El alcohol bencílico podría interactuar con la eosina de varias maneras, porque la eosina es una molécula bastante grande y complicada (al menos en esta etapa de sus estudios). Podríamos imaginar interacciones ión-dipolo, en las que los hidrógenos parcialmente positivos en los grupos OH en el alcohol bencílico interactúan con los oxígenos aniónicos de la eosina, o los oxígenos parcialmente negativos en el alcohol bencílico interactúan con el ion calcio positivo.

Sin embargo, la parte polar del alcohol bencílico es realmente la parte más pequeña de la molécula. La mayor parte de las moléculas es el benceno, un anillo de carbono de seis miembros con tres dobles enlaces. Los carbonos en los extremos de esos dobles enlaces son planos trigonales, por lo que debido a que el benceno se construye a partir de átomos planos, es completamente plano. Los enlaces C-C no son polares, y los enlaces C-H apenas son polares en absoluto, por lo que el IMF dominante en esta parte de la molécula es la dispersión de Londres o la interacción dipolo inducida por dipolo inducido. Esa es una interacción bastante débil en general, pero puede hacerse un poco más fuerte entre moléculas grandes, o entre las planas, porque dos moléculas planas pueden tener más área de superficie en contacto entre sí. Eso significa que los bencenos en alcohol bencílico y los bencenos en eosina tienen apreciables fuerzas londinenses que les permiten interactuar entre sí.
p) Con la celulosa, cubierta en grupos OH, las interacciones polares señaladas anteriormente serán más prominentes.
Ejercicio 7.14.5:
- OAc es un éster.
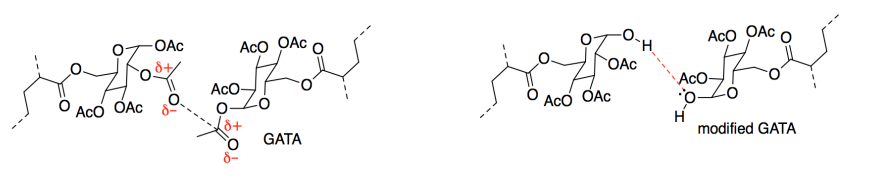
- AAI tiene tres centros quirales; GATA tiene cinco.
- Las cadenas en el adhesivo se pegarían entre sí a través de atracciones intermoleculares. Las atracciones dipolo-dipolo serían las más fuertes. Sin embargo, el dipolo inducido inducido o las fuerzas de dispersión de Londres serían realmente significativas porque habría cientos de tales interacciones a lo largo de las cadenas.
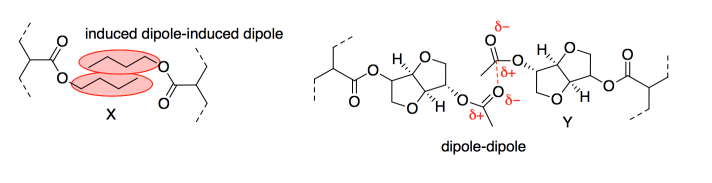
- La interacción más significativa con el papel serían los enlaces de hidrógeno. La celulosa en el artículo proporcionaría donantes de enlaces de hidrógeno (los grupos OH) y los grupos laterales en las cadenas adhesivas proporcionarían aceptores de enlaces de hidrógeno (todos esos oxígenos). Sin embargo, si el papel contiene mucho tamaño, el dipolo inducido inducido por dipolo o las fuerzas de dispersión de Londres pueden formar una parte significativa de la interacción. Al igual que con la cohesión, esto no sería un factor significativo salvo que hay tantas cadenas alquílicas involucradas, por lo que estas diminutas atracciones sumarían.