7.14: Problemas de aplicación
- Page ID
- 80712
Ejercicio\(\PageIndex{1}\)
El limpiador, Goof Off (el removedor MIRACLE)®, se anuncia para eliminar grasa, aceite y cera de las superficies. Goof Off está compuesto por una mezcla de xileno y etilbenceno. Las estructuras de estos compuestos se muestran a continuación:
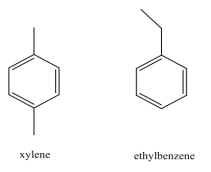
La grasa, el aceite y la cera son compuestos hidrocarbonados. ¿Por qué Goof Off® funciona mejor que el agua para eliminar estas sustancias? Para respaldar su respuesta, use tablas del FMI para determinar:
a) el FMI más fuerte entre el agua y el agua;
b) Goof Off® y Goof Off;
c) Goof Off® y grasa; y
d) FMI más fuerte entre grasa y agua.
¿Por qué Goof-off funciona mejor para disolver la grasa y el aceite que si solo usas agua?
- Contestar a

- Respuesta b
-

- Respuesta c
-

- Respuesta d
-

La clave de por qué funciona la tontería es que se involucra en las mismas interacciones de dispersión londinense con la grasa que la grasa misma. El agua es buena para disolver muchas cosas, pero no la grasa. Eso se debe principalmente a que el agua tendría que renunciar a algunos de los fuertes enlaces de hidrógeno con otras moléculas de agua para encajar las moléculas de grasa entre las moléculas de agua.
Ejercicio\(\PageIndex{2}\)
A menudo, se agrega una pinta de anticongelante de línea de gas (comúnmente llamado “HEET”, después de una marca popular) a los tanques de gasolina de los automóviles, especialmente en los días más fríos del invierno, para evitar la congelación de la línea de gas. (Pequeñas cantidades de agua en la gasolina pueden congelarse cuando hace mucho frío. Esto bloquea la línea de combustible y detiene el motor.)
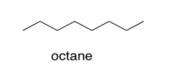
a) Supongamos que la gasolina es octano puro (C 8 H 18). ¿Cuál es la fuerza del FMI más fuerte entre las moléculas de octano en la gasolina?
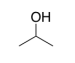
b) Un tipo de anticongelante de línea de gas contiene casi 100% alcohol isopropílico, que se muestra a continuación ¿Cuál es el FMI más fuerte entre dos moléculas de alcohol isopropílico?
c) El alcohol isopropílico es completamente soluble tanto en agua como en gasolina. ¿Por qué? Considere al FMI involucrado cuando el alcohol isopropílico es:
i) interactuar con el agua
ii) Interactuar con octano
d) Cuando se agrega HEET a un tanque de gas tiende a provocar que el agua se disuelva (o al menos permanezca suspendida) en la gasolina. Mostrar en una imagen y explicar cómo sucede esto, a nivel molecular.
e) Se requiere que toda la gasolina en Minnesota contenga 10% de etanol (CH 3 CH 2 OH). Dada esta formulación, ¿un minnesotano necesitaría usar HEET? Explique.
- Contestar a
-

- Respuesta b
-

- Respuesta c
-

- Respuesta e
-
No, el etanol debería hacer lo mismo que el HEET.
Ejercicio\(\PageIndex{3}\)
El laboratorio de Samuel Stupp en Northwestern diseña moléculas con aplicaciones biomédicas potenciales. El siguiente compuesto se realizó para promover la regeneración ósea en la superficie celular. El hueso está compuesto principalmente por fosfato de calcio, Ca 3 (PO 4) 2 (Adaptado con permiso de Liam C. Palmer, Christina J. Newcomb, Stuart R. Kaltz, Erik D. Spoerke y Samuel I. Stupp, Chem. Rev. 2008, 108, 4754-4783. Copyright 2018 American Chemical Society.).
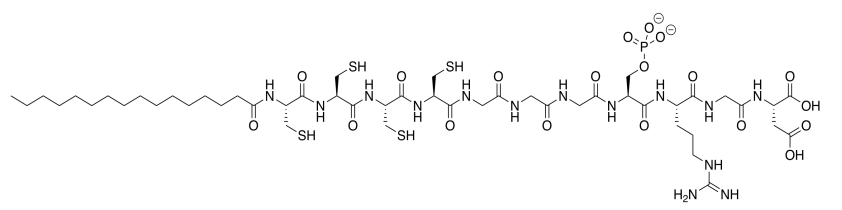
a) Esta molécula es un anfífilo sintético; tiene un extremo polar y un extremo no polar. Poner un rectángulo alrededor de la parte polar de esta molécula. Circula la parte no polar de la molécula.
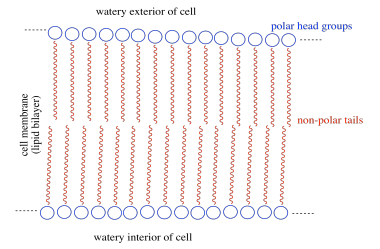
b) El anfífilo se inserta en la membrana celular. A continuación se muestra una caricatura de una porción de una membrana celular. Agrega una caricatura del anfífilo sintético a la membrana. ¿Qué es el FMI a través del cual interactúa con la membrana?
c) En base a su posición en la tabla periódica, ¿cuál es la carga sobre un ion calcio?
d) Con base en la carga neutra global del fosfato de calcio, Ca 3 (PO 4) 2, ¿cuál es la carga sobre el fosfato?
e) ¿Cuál es la ventaja de que el hueso esté compuesto de calcio y fosfato en lugar de iones más comunes como el sodio y el cloruro?
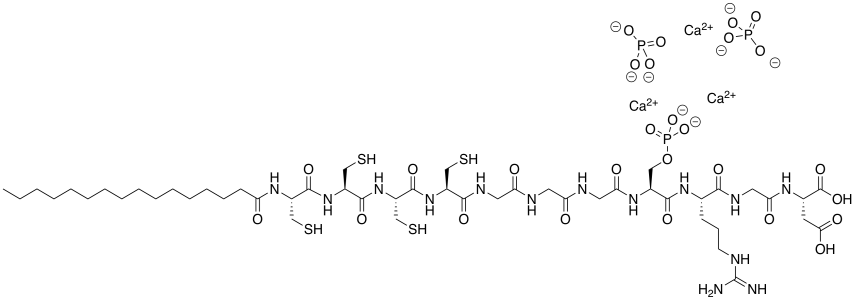
f) Mostrar cómo este anfífilo promovería el crecimiento óseo.
- Respuesta a:
-

- Respuesta b:
-
- Respuesta c:
-
Ca 2+ (dos átomos desde el borde izquierdo).
- Respuesta d:
-
PO 4 3- porque 3 x (2 +) + 2 x (3 -) = 0; carga neutra general.
- Respuesta e:
-
Estas altas cargas (2 + /3 -) se unen mucho más fuertemente que las cargas bajas (1 + /1 -) en cloruro de sodio.
- Respuesta f:
-
Ejercicio\(\PageIndex{4}\)
Hagamos un poco de papel.
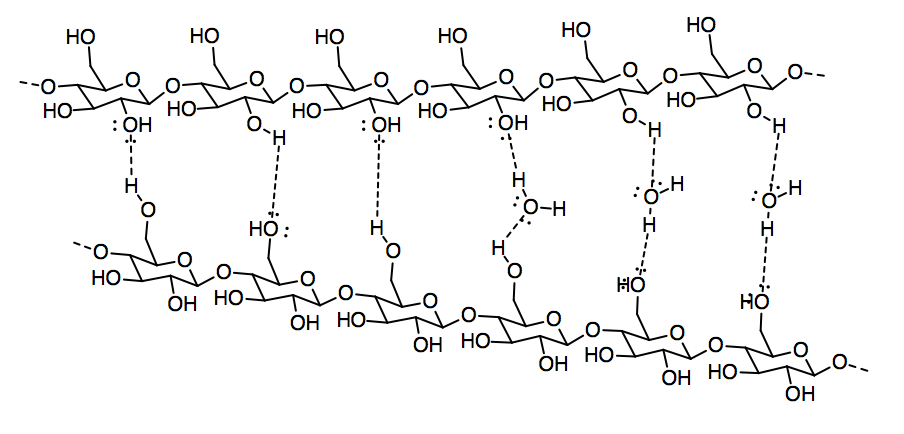
El papel está hecho de fibras de celulosa que se pegan entre sí para formar una hoja. La celulosa, a su vez, es un polímero hecho de moléculas de glucosa individuales unidas entre sí en una cadena.
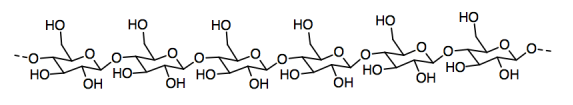
a) Circular una unidad individual de glucosa en la celulosa.
b) Nombrar y dibujar el FMI que mantiene juntas dos cadenas de celulosa.
Uno de los problemas en la fabricación de papel es que la fuente más importante de celulosa es generalmente la pulpa de madera. La pulpa de madera se diferencia de otros materiales vegetales en que contiene lignina.
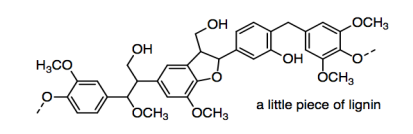
La lignina es bastante importante en las plantas —proporciona rigidez estructural o rigidez que permite que los árboles crezcan mucho más altos que otras plantas— pero no es útil en papel. Se deja en bolsas de papel marrón (papel kraft), pero esas se rasgan más fácilmente que el papel al que se le ha quitado la lignina.
c) Mostrar por qué la lignina debilitaría la interacción entre las moléculas de celulosa.
Uno de los problemas con el papel es que puede absorber agua e hincharse; incluso puede disolverse si hay suficiente agua.
d) Mostrar por qué el papel absorbe el agua con tanta facilidad.
Una forma de combatir la absorción de humedad es agregar aprestamiento al papel. El encolado se puede mezclar con el puré de celulosa antes de enrollarlo en hojas (“encolado interno”), o se puede rociar sobre la hoja de papel después de enrollarla (“encolado de la superficie”). La colofonia, también obtenida de los árboles, es una fuente común de dimensionamiento; uno de sus componentes principales es el ácido abiético.
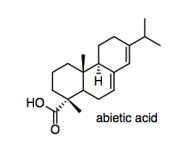
e) Para modificar las propiedades del papel, la colofonia deberá pegarse al papel. Explique cómo lo hace.
f) ¿Cómo la colofonia hace que el papel sea más resistente al agua?
Una fuente muy antigua de dimensionamiento era el pegamento de piel de conejo; la gelatina es un material relacionado que todavía se usa como dimensionamiento hoy en día (además de ser la base de un postre jiggly). Estos materiales son en su mayoría proteínas, ricas en glicina, prolina, alanina, fenilalanina, leucina y valina, entre otros aminoácidos.
g) ¿Cómo se pegaría una proteína al papel?
h) ¿Qué tipo de residuos de aminoácidos harían que el papel sea resistente al agua?
El papel crudo es bastante transparente, por lo que generalmente se agregan opaquificadores. Hacen un material más opaco para que puedas escribir por ambos lados. El dióxido de titanio es un opaquificador común.
i) Para llegar a una configuración de gas noble, ¿cuál sería la carga de un ion Ti? ¿Un ion O?
j) Por lo tanto, ¿cuál es la fórmula del óxido de titanio (la relación de los iones en el compuesto)?
k) El óxido de titanio no se disuelve muy bien en el agua. ¿Por qué no?
l) El óxido de titanio se pega en la tela del papel. Nombrar al FMI.
m) En la imagen, la O es oscura y la luz Ti (crédito de la imagen: Ben Mills; dominio público). Calcular el número de cada átomo en la celda unitaria.
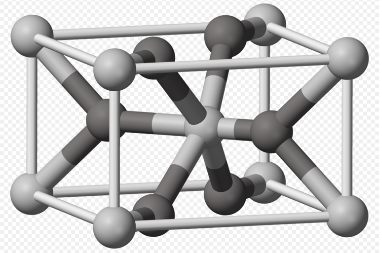
n) Describir el tipo de celda unitaria formada solo por los átomos de Ti.
Tendremos que probar el papel escribiendo en él. En un bolígrafo, la tinta (como eosina roja, utilizada para calificar tus composiciones en clase de inglés) se suspende o disuelve en un aceite ligero como el alcohol bencílico.
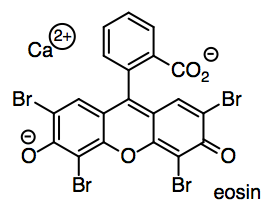
o) ¿Cómo se disuelve la eosina en alcohol bencílico? Mostrar y nombrar un tipo de FMI en el dibujo.
p) ¿Por qué se pegará la eosina al papel?
- Respuesta a:
-
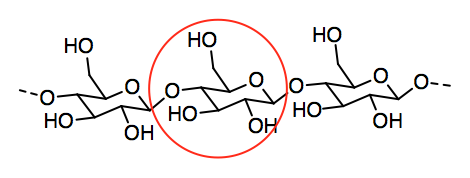
- Respuesta b:
-
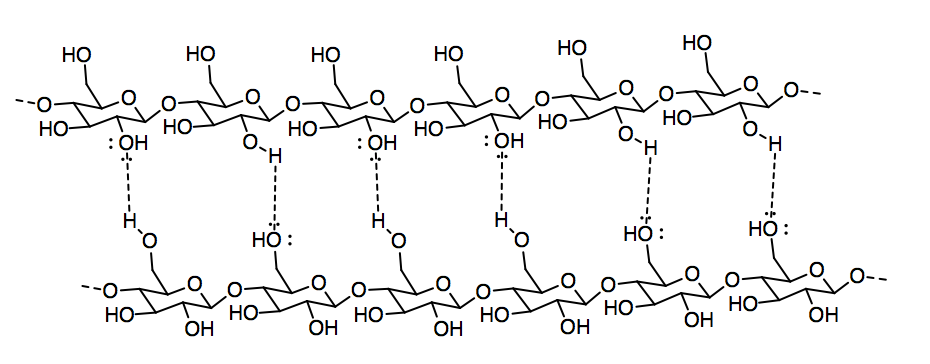
- Respuesta c:
-
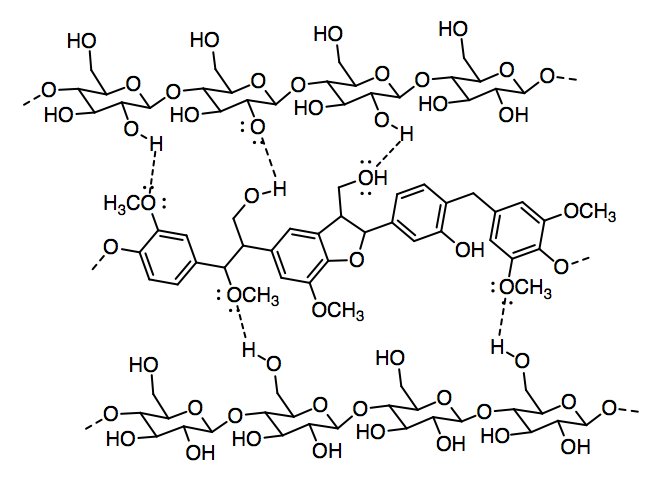
- Respuesta d:
-
- Respuesta e:
-
El grupo ácido carboxílico proporciona sitios para enlaces de hidrógeno, incluyendo tanto un donador de enlace de hidrógeno en el grupo OH como un aceptor de enlace de hidrógeno adicional en el grupo C=O.
- Respuesta f:
-
Introduce una parte “hidrofóbica” en la que la mayor fuerza intermolecular con el agua sería una interacción dipolo inducida por dipolo. Si las moléculas de agua se mantienen solas, podrán maximizar la cantidad de enlaces de hidrógeno que pueden hacer entre sí. Es mejor que el agua no se mezcle con el papel.
- Respuesta g:
-
Todas las proteínas tienen cadenas principales polares formadas por sus enlaces amida o enlaces peptídicos (-NH-C=O). Estas porciones pueden formar enlaces de hidrógeno con la celulosa en el papel. Además, puede haber cadenas laterales polares como serina o treonina, por ejemplo, que contienen grupos OH que pueden enlazar hidrógeno con el papel.
- Respuesta h:
-
Los residuos hidrófobos agregarían resistencia al agua, por la misma razón que la parte hidrofóbica del ácido abiético en la colofonia.
- Respuesta i:
-
Ti 4+ tendría la misma configuración electrónica que el argón. O 2- tendría la misma configuración electrónica que el neón.
- Respuesta j:
-
La fórmula es TiO 2, de manera que se equilibran las cargas positivas (4 +) y las cargas negativas (2 x 2 - = 4 -).
- Respuesta k:
-
Los cargos de 4 + y 2 son bastante grandes. Los iones altamente cargados son difíciles de disolver, porque la atracción ión-dipolo del ion con el agua no puede competir con las muy fuertes atracciones iónicas entre los iones.
- Respuesta l:
-
Dipolo de iones. Se pueden imaginar los átomos de oxígeno parcialmente negativos de la celulosa interactuando con los cationes de titanio y los hidrógenos parcialmente positivos de los grupos OH en la celulosa interactuando con los aniones óxido.
- Respuesta m:
-
Ti: un átomo completo en el centro y ocho en las esquinas, por lo que 1 + 8x (1/8) = 2 átomos de Ti.
O: dos átomos completos (hacia los extremos izquierdo y derecho de la imagen) más cuatro medios átomos (en las caras superior e inferior de la celda), por lo que 2 + 4x (1/2) = 4 átomos de O.
relación: 1 Ti: 2 O o TiO 2 en notación de fórmula.
- Respuesta n:
-
Los Ti se empaquetan en una celda que se asemeja a una celda cúbica centrada en el cuerpo. No obstante, la celda no es realmente cúbica, porque está un poco estirada. A veces llamamos a esa forma “tetragonal”.
- Respuesta o:
-
El alcohol bencílico podría interactuar con la eosina de varias maneras, porque la eosina es una molécula bastante grande y complicada (al menos en esta etapa de sus estudios). Podríamos imaginar interacciones ión-dipolo, en las que los hidrógenos parcialmente positivos en los grupos OH en el alcohol bencílico interactúan con los oxígenos aniónicos de la eosina, o los oxígenos parcialmente negativos en el alcohol bencílico interactúan con el ion calcio positivo.
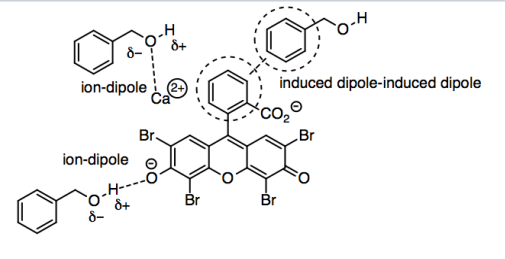
Sin embargo, la parte polar del alcohol bencílico es realmente la parte más pequeña de la molécula. La mayor parte de las moléculas es el benceno, un anillo de carbono de seis miembros con tres dobles enlaces. Los carbonos en los extremos de esos dobles enlaces son planos trigonales, por lo que debido a que el benceno se construye a partir de átomos planos, es completamente plano. Los enlaces C-C no son polares, y los enlaces C-H apenas son polares en absoluto, por lo que el IMF dominante en esta parte de la molécula es la dispersión de Londres o la interacción dipolo inducida por dipolo inducido. Esa es una interacción bastante débil en general, pero puede hacerse un poco más fuerte entre moléculas grandes, o entre las planas, porque dos moléculas planas pueden tener más área de superficie en contacto entre sí. Eso significa que los bencenos en alcohol bencílico y los bencenos en eosina tienen apreciables fuerzas londinenses que les permiten interactuar entre sí.
- Respuesta p:
-
Con la celulosa, cubierta en grupos OH, las interacciones polares señaladas anteriormente se volverán más prominentes.
Ejercicio\(\PageIndex{5}\)
Hagamos una Post-It Note©. Las Notas Post-It son básicamente trozos de papel pegajosos. Si vamos a hacer uno, vamos a necesitar algún papel. Una vez que tengas el papel, necesitaremos un adhesivo para que quede pegajoso.
Investigadores del laboratorio de Teresa Reineke de la Universidad de Minnesota han desarrollado nuevos adhesivos a base de azúcares, un recurso renovable (Nasiri, M.; Saxon, D. L.; Reineke, T. M. Macromolecules 2018, 51, 2456-2465. Copyright 2018, Sociedad Americana de Química. Usado con permiso.). Los adhesivos son cadenas largas de polímero que contienen alrededor de 800 grupos X en una fila, con entre 12 y 90 grupos Y en cada extremo.
Intentaron dos tipos diferentes de grupos Y: AAI y GATA.
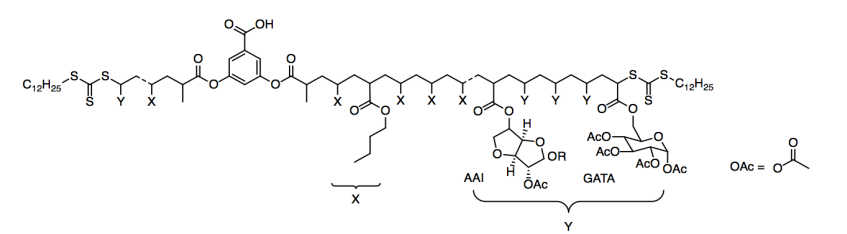
a) ¿Qué tipo de grupo funcional es OaC?
b) ¿Cuántos centros quirales se encuentran en el grupo AAI? ¿En el grupo GATA?
Un buen pegamento tiene un equilibrio entre la adherencia —pegarse a otra cosa— y la cohesión- pegarse. Si hay muchas de estas cadenas en el adhesivo (como hebras de espagueti), pueden pegarse entre sí a través de fuerzas intermoleculares.
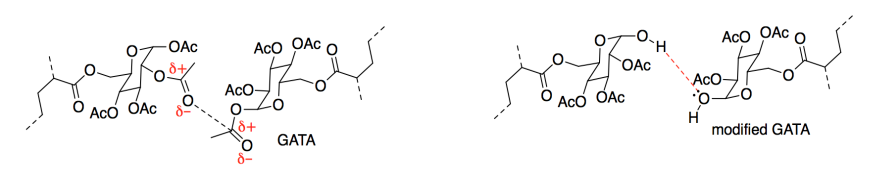
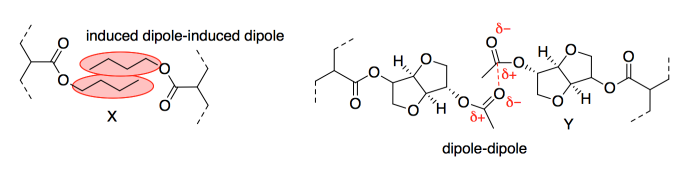
c) Mostrar y nombrar los IMF que se producirían entre (i) dos cadenas alquílicas en el grupo X; (ii) los grupos éster en GATA.
d) ¿Qué IMF lleva a una buena adhesión del polímero al papel?
En una prueba de cizallamiento estático, se pega un peso de 1 libra sobre una superficie vertical con el adhesivo, y se mide el tiempo que tarda en caerse. La versión AAI superó a la versión GATA (6000 vs. 800 minutos). Sin embargo, el laboratorio realizó una ligera alteración en el GATA y el tiempo de adhesión se duplicó (a 1600 minutos).
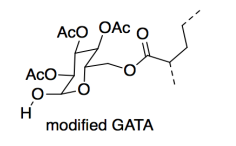
Pensando sólo en la cohesión, ¿por qué mejoró la fuerza del material?
e) Mostrar y nombrar al FMI en un dibujo del GATA modificado. Compara su fortaleza con el FMI al que sustituye en el GATA original.
El laboratorio también realizó una prueba de adherencia al pelado. Midieron la fuerza requerida para pelar la “nota post-it” de una superficie. Tanto las versiones GATA como AAI superaron a Scotch© Tape, cinta adhesiva y Post-It © Notes genuinos.
- Respuesta a:
-
OAc es un éster.
- Respuesta b:
-
AAI tiene tres centros quirales; GATA tiene cinco.
- Respuesta c:
-
Las cadenas en el adhesivo se pegarían entre sí a través de atracciones intermoleculares. Las atracciones dipolo-dipolo serían las más fuertes. Sin embargo, el dipolo inducido inducido o las fuerzas de dispersión de Londres serían realmente significativas porque habría cientos de tales interacciones a lo largo de las cadenas.
- Respuesta d:
-
La interacción más significativa con el papel serían los enlaces de hidrógeno. La celulosa en el artículo proporcionaría donantes de enlaces de hidrógeno (los grupos OH) y los grupos laterales en las cadenas adhesivas proporcionarían aceptores de enlaces de hidrógeno (todos esos oxígenos). Sin embargo, si el papel contiene mucho tamaño, el dipolo inducido inducido por dipolo o las fuerzas de dispersión de Londres pueden formar una parte significativa de la interacción. Al igual que con la cohesión, esto no sería un factor significativo salvo que hay tantas cadenas alquílicas involucradas, por lo que estas diminutas atracciones sumarían.
- Respuesta e:
-