8.1: Lípidos
- Page ID
- 80615
Ácidos grasos: anfífilos de cadena sencilla
Considera el ácido esteárico, un tipo de lípido conocido como ácido graso. Tiene una cadena de 18 átomos de C con un grupo ácido carboxílico (RCO 2 H) en un extremo.
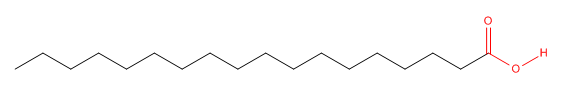
El extremo carboxilo (mostrado en rojo) que contiene los dos oxígenos es polar, pero el resto de la molécula es completamente no polar. Podemos dibujar un modelo de “caricatura” de esta molécula como un círculo que representa el extremo polar carboxilo o “grupo de cabeza” con una sola línea de conexión que representa la “cola” larga y no polar.

Una molécula que contiene una región polar distinta y una región no polar monocatenaria distinta se denomina anfífilo monocatenario.
¿Cómo interactuaría este ácido graso con el agua? Un pequeño número de estas moléculas podría ser soluble en agua (recuerde que incluso las sales insolubles se disocian en un pequeño grado para formar algunos iones). La cola no polar no es estable en el agua, pero la cabeza polar sí. Algunas de las moléculas migran a la superficie del agua, con las colas no polares sobresaliendo en el aire y lejos del agua, formando una monocapa en la superficie. Otros se autoagregarán a través de IMF para formar una estructura esférica en la que las colas no polares son secuestradas del agua y las cabezas polares están enfrentadas al agua. Esta estructura se llama micela. En la siguiente figura, los grupos de cabeza polar se muestran en azul.
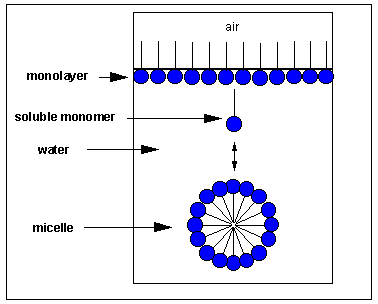
¿Qué IMF están involucrados? Primero considere IMF atractivos. Las cadenas no polares enterradas pueden interactuar y estabilizarse a través de las fuerzas londinenses. Enterradas dentro de la micela, las cadenas no polares son secuestradas del agua. Esta vista se ajusta a nuestro axioma simple de “como se disuelve como”. Los grupos de cabeza polar pueden estabilizarse mediante interacciones ión-dipolo entre grupos de cabeza cargados y agua. Asimismo, los enlaces H entre el agua y el grupo de cabeza estabilizan los grupos de cabeza expuestos en el agua. También están involucradas fuerzas repulsivas. Los grupos de cabeza pueden repelerse entre sí a través de factores estéricos o repulsión de iones de iones de grupos de cabezas con carga similar. Las fuerzas atractivas deben ser mayores que las fuerzas repulsivas, conduciendo a la formación de micelas.
 Jmol: Micelle Jmol14 (Java) | JSmol (HTML5)
Jmol: Micelle Jmol14 (Java) | JSmol (HTML5)Los detergentes son moléculas, como los ácidos grasos, que tienen regiones polares y no polares distintas y separadas. Forman micelas en el agua. La grasa de la ropa o los alimentos, normalmente no soluble en agua, puede “sumergirse” en el medio de la micela y ser transportada por esta estructura. Esto efectivamente “solubiliza” la molécula no polar. Observe que no hay agua dentro de la micela como puede ver en la figura y el modelo de computadora Jmol arriba.
Fosfolípidos: Anfípilos de Doble Cadena
Consideremos ahora otro lípido, un fosfolípido, el ejemplo que se muestra a continuación. X representa un grupo polar que contiene un fosfato cargado.
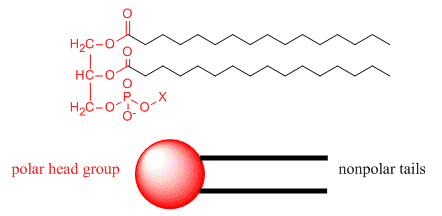
Tenga en cuenta que tiene un extremo polar (se muestra en rojo), pero en contraste con el ácido esteárico, tiene dos largas colas no polares mostradas en negro. Podemos dibujar un modelo de “caricatura” de esto como un círculo que representa el extremo polar o “grupo de cabeza” con dos líneas de conexión que representan las dos largas “colas” no polares. Es un anfífilo de doble cadena. Los fosfolípidos son el componente principal de las membranas biológicas. Nuevamente, en la siguiente figura, los grupos de cabeza polar se muestran en azul.
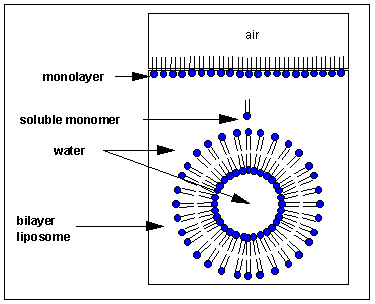
¿Cómo interaccionaría este fosfolípido con el agua? Nuevamente, al igual que con los detergentes de cadena simple, existen varias formas posibles. Un pequeño número de estas moléculas podría ser soluble en agua. Las colas no polares son inestables en el agua, mientras que la cabeza polar es estable en el agua. Como en el caso de los detergentes monocatenarios, algunas de las moléculas migran a la superficie del agua, con las colas no polares sobresaliendo al aire, lejos del agua, para formar una monocapa en la parte superior del agua. Otros se autoagregarán a través de IMF para formar una bicapa o membrana en lugar de una micela, que solo contiene anfífilos monocatenarios. Los grupos de cabeza polar en un anfífilo de cadena doble pueden acercarse más que en una micela ya que hay interacciones estabilizantes adicionales entre las cadenas laterales. El resultado es la formación de una bicapa de membrana que proporciona menos espacio para cada grupo de cabeza que en una micela. Imagínese la membrana bicapa curvándose alrededor y finalmente encontrándose a sí misma. Una estructura como esta se vería como una pequeña célula biológica. A diferencia de una micela, el interior de este agregado lipídico multimolecular, llamado liposomas o vesículas, está lleno de agua que puede interactuar a través de IMF con los grupos de cabeza de la valva interna de esta membrana. Los grupos de cabeza de la valva externa de la membrana interactúan a través de IMF con el agua a granel.
 Jmol: Bicapa no hidratada Jmol14 (Java) | JSmol (HTML5)
Jmol: Bicapa no hidratada Jmol14 (Java) | JSmol (HTML5)Los liposomas son útiles ya que son modelos simples de membranas biológicas reales. Además, se pueden usar terapéuticamente. Los fármacos tóxicos, como los utilizados en la quimioterapia, se pueden incorporar al volumen acuoso dentro de un liposomas donde pueden ser dirigidos a células tumorales específicas.
Los liposomas y las micelas parecen ser estructuras complicadas. Sin embargo, su formación y estructura se pueden predecir a partir de las simples propiedades de solubilidad de estas moléculas y a través de una comprensión de los IMF.
¿Alguna vez te has preguntado por qué una solución de hidróxido de sodio (una base) se siente resbaladiza en tu piel? La base de hidróxido escinde el enlace entre los ácidos grasos conectados a fosfolípidos cutáneos más complejos. Los ácidos grasos libres luego se agregan espontáneamente para formar micelas que actúan como detergentes que, como saben, también se sienten resbaladizos.
Triacilglicéridos
Hemos visto las estructuras de un solo ácido graso y de un fosfolípido que contiene dos ácidos grasos ligados al glicerol. Otro lípido muy abundante contiene tres ácidos grasos conectados al glicerol para formar un triacilglierida, como se muestra a continuación.
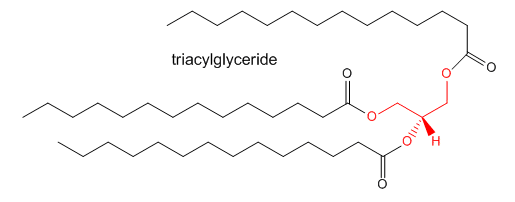
Esta molécula en general es tan no polar que se autoasocia para formar gotas lipídicas que se almacenan predominantemente en grasa o tejido adiposo en el cuerpo. En lugar de tener un papel estructural, funciona principalmente como fuente de energía.
Ejercicio\(\PageIndex{1}\)
Hemos discutido cómo los lípidos pueden formar agregados en solución acuosa. Ahora vamos a revertir el escenario. Dibuje un diagrama que muestre lo que podría suceder si se agregaran muchas moléculas de ácido esteárico al solvente hexano, C 6 H 14.
Ejercicio\(\PageIndex{2}\)
Una propiedad importante de una micela es el área superficial/grupo de cabeza (A S/HG). Esto es igual a la superficie total de la micela dividida por el número de anfífilos monocatenarios en la micela, A tot/#amphiphiles.
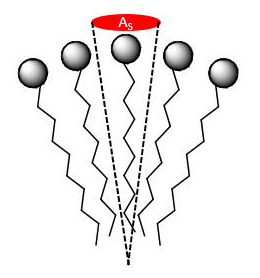
¿Qué tipo de fuerzas repulsivas existen entre los grupos de cabeza? ¿Qué sucede con A S/HG si aumenta la carga total en el grupo head? ¿Disminuye? ¿Cómo afectarían los IMF entre las cadenas no polares a la estabilidad micelar?
Ejercicio\(\PageIndex{3}\)
Imagina ahora que aplastas la micela esférica en una bicapa. Piensa en esto como aplanar una pelota de tenis. ¿Qué pasaría con el (A S/HG)? (Pista: Piense en lápices que sobresalen radialmente de la pelota de tenis, con las gomas de borrar representando grupos de cabezas. ¿Qué pasa con el espaciado del borrador ya que la pelota de tenis se distorsiona a una bicapa?. ¿Cómo explica esto por qué los anfífilos de cadena sencilla de carga no forman bicapas?
Ejercicio\(\PageIndex{4}\)
Ahora prueba un experimento de pensamiento diferente. Agrega más y más del mismo anfífilo monocatenario a una micela esférica. La forma debe desviarse de una esfera. ¿Por qué? Dibuja un diagrama de dibujos animados para ilustrar tu punto. En este caso el agregado lipídico puede crecer si adopta una forma cilíndrica. Compare el (A S/HG) para las formas esféricas, cilíndricas y bicapa. ¿Cuál de estas formas es más probable que se forme
Ejercicio\(\PageIndex{5}\)
Ahora consideremos una bicapa hecha de anfífilos de doble cadena (se muestra a continuación). Comparar la A S/HG para una bicapa con un escenario donde el anfífilo de doble cadena forma una micela? Ahora dibuja un diagrama de dibujos animados para explicar la observación de que los anfífilos de cadena doble no forman micelas (fíjese en la bicapa que se muestra).

Ejercicio\(\PageIndex{6}\)
Ahora explique cómo los anfífilos de cadena doble pueden tolerar el empaquetamiento cercano de los grupos de cabeza que se encuentran en la bicapa mientras que los anfífilos de cadena simple generalmente no pueden.
Ejercicio\(\PageIndex{7}\)
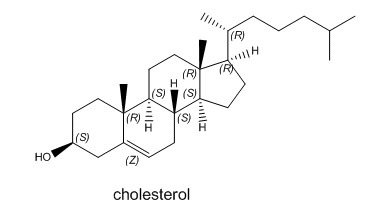
Hay muchos otros tipos diferentes de lípidos. A continuación se muestra un ejemplo, el colesterol. Esta molécula tiene muchas funciones biológicas. A menudo se encuentra en bicapas lipídicas. Dibuja una caricatura que muestre cómo el colesterol podría encajar en una bicapa.