10.3: Silicatos y Sílice
- Page ID
- 80621
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Alrededor del 90% de la corteza terrestre está compuesta por minerales de silicato. Los silicatos son compuestos compuestos por silicio y oxígeno; estos compuestos tienen cargas negativas sobre ellos. Eso significa que hay contraiones positivos que se encuentran junto con estos aniones. La variedad de cationes posibles, que van desde el sodio y el potasio hasta el cobre y el hierro, es uno de los factores que conducen a una deslumbrante variedad de minerales de silicato.
Además de tener una amplia gama de cationes posibles, los propios aniones de silicato tienen una amplitud de estructuras disponibles. Estas estructuras van desde aniones individuales de silicato (SiO 4 4-) hasta redes tridimensionales de tetraedros.
Los silicatos no son necesariamente sólidos de red, pero veremos que sus estructuras van desde sólidos iónicos directos en un extremo hasta algo que se parece cada vez más a una red extendida en el otro. Al observar estos materiales podemos aprender un poco más sobre los sólidos de la red relacionados.
Nesosilicatos
Los nesosilicatos (que significa silicatos de “isla”) son aniones individuales de silicato dispuestos en sólidos iónicos cristalinos con sus contraiones. Esos iones individuales significan que los nesosilicatos no son sólidos de red en absoluto. Representan el extremo, otro extremo del espectro de estructuras de silicato.
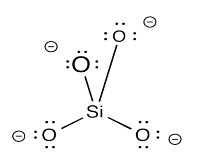
El anión nesosilicato forma una forma tetraédrica. El átomo de silicio está en el centro y los átomos de oxígeno están en las cuatro esquinas. Esa forma tetraédrica a menudo se ilustra en dibujos estructurales en lugar de dibujar explícitamente los átomos. En lugar de mostrar el anión SiO 4 - con átomos marcados a la izquierda, se muestra el tetraedro de la derecha para representarlo.
Los silicatos pueden tener muchos cationes diferentes. Con frecuencia, se pueden encontrar varios cationes diferentes en un solo material. Por ejemplo, el olivino es un nesosilicato bastante común con cationes de magnesio y hierro (Mg 2+ y Fe 2+). Si el olivino es de muy alta calidad, puede ser una piedra preciosa, llamada peridoto.
Hay dos formas limitantes de olivino, llamadas “miembros finales”. En un extremo está forsterita, Mg 2 SiO 4. En el otro extremo está fayalita, Fe 2 SiO 4. En el medio se encuentra toda combinación posible de magnesio y hierro. Podría haber cantidades iguales de magnesio y hierro, o podría haber solo unos pocos iones de magnesio y muchos, muchos iones de hierro en una muestra.
- Los minerales ocurren frecuentemente en familias, en las que uno, ion similar puede ser sustituido por otro.
- Frecuentemente, ambos iones pueden estar presentes en cantidades variables, pero las propiedades del material (como el color) cambian con las relaciones cambiantes de estos iones.
- Los minerales que tienen solo uno de los posibles iones pero no el otro se llaman los miembros finales de la familia.
Otro nesosilicato común es el granate. Los granates se utilizan como gemas así como abrasivos, a veces se usan en papel de lija. Hay muchos tipos de granate, pero uno común es la almandina, cuyo color rojo-marrón del que solemos pensar como “granate”. Los granates siempre contienen dos cationes diferentes. Uno de ellos es un ion M 2+ y el otro es un ion M 3+ (M aquí solo significa “metal”). Estos dos contraiones están siempre presentes en una proporción 3:2 en granate.
Ejercicio\(\PageIndex{1}\)
Demostrar que la forsterita y la fayalita son neutrales en general.
- Respuesta a:
-
forsterita: Mg 2 SiO 4: Si cada unidad de nesosilicato tiene una carga de 4 - debido a las cargas formales en los cuatro oxígenos, entonces los dos magnesios deben combinarse para equilibrar esa carga con una carga 4 +. Cada magnesio debe tener una carga 2 + propia. Eso parece razonable, ya que el magnesio está a dos átomos del borde izquierdo de la tabla periódica; tendría una carga 2 + en una configuración de gas noble.
- Respuesta b:
-
fayalita: Fe 2 SiO 4: Para que esto funcione, cada plancha tendría que tener una carga de 2 +. Las cargas de metales de transición son más difíciles de predecir que los metales alcalinos y alcalinotérreos porque están más lejos del borde de la tabla periódica, pero resulta que las dos cargas más comunes en un ion hierro son 2 + y 3 +, por lo que esta carga parece razonable.
Ejercicio\(\PageIndex{2}\)
Supongamos que un olivino tiene 100 aniones nesosilicato por cada 25 iones de magnesio.
- ¿Cuántos iones de hierro (supongamos Fe 3+) habría en el olivino neutro?
- ¿Cuáles serían los valores de x e y en Mg x Fe y SiO 4?
- Respuesta a:
-
Si cada nesosilicato tiene una carga de 4 -, entonces la carga negativa total es de 100 x 4 - = 400 -. Si hay 25 iones magnesio, cada uno con una carga 2 +, la carga positiva total es de 25 x 2 + = 50 +. Eso deja una carga neta negativa de 400 - + 50 + = 350 -. Los hierros equilibrarían esa carga con una carga igual positiva. El número de iones hierro sería 350+/3+ = 150.
- Respuesta b:
-
Si dividimos estas proporciones por 100 para llegar al único nesosilicato en la fórmula, obtenemos Mg 0.25 Fe 1.5 SiO 4. No significa que haya una cuarta parte de un ion magnesio en cualquier lugar; esta fórmula es solo la relación general de átomos.
Ejercicio\(\PageIndex{3}\)
La almandina es un nesosilicato. Contiene aluminio (que casi siempre es Al 3+ en la naturaleza) y hierro (en este caso Fe 2+) en una proporción 2:3. ¿Cuál es su fórmula?
- Contestar
-
Hasta el momento tenemos Al 2 Fe 3. La carga positiva = 2 x 3 + + 3 x 2 + = 12 +. Esa carga debe ser equilibrada por los aniones nesosilicato, que son cada uno 4 -. Entonces el número de silicatos es 12 - /4 - = 3. La fórmula es Al 2 Fe 3 (SiO 4) 3.
Sorosilicatos
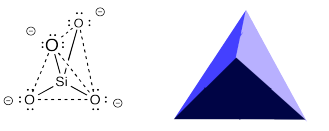
Los sorosilicatos (silicatos “hermanos”) son dímeros aniones de silicato. Las dos unidades de silicato comparten un átomo de oxígeno. En la representación poliédrica, los dos tetraedros comparten una esquina. Los sorosilicatos claramente tampoco son sólidos de red. Simplemente contienen aniones ligeramente más grandes que los nesosilicatos.

Los sorosilicatos no son tan comunes como los nesosilicatos. Donde existen, los sorosilicatos se encuentran en presencia de otros aniones, así como cationes. En algunos minerales, incluso se encuentran en combinación con nesosilicatos. Por ejemplo, la epidota es una forma más común de mineral que contiene sorosilicato. Podría ser de varios colores pero suele ser verde. Contiene aniones nesosilicato, sorosilicato, óxido e hidróxido, así como cationes calcio, hierro y aluminio.
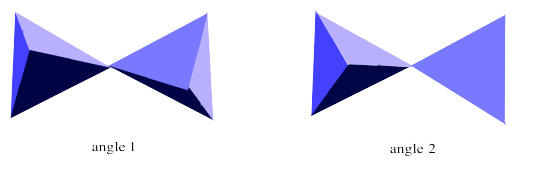
El anión sorosilicato en realidad puede adoptar diferentes formas en diferentes casos. Contiene dos unidades que pueden torcerse una respecto a la otra. Las diferentes formas que resultan se denominan “conformaciones”. A continuación se muestra una conformación diferente. En la imagen de la izquierda, la estamos viendo desde el mismo ángulo que el orosilicato que se muestra arriba. En la imagen de la derecha la estamos mirando desde un ángulo diferente para enfatizar que los dos tetraedros están apuntando en direcciones opuestas. Estamos mirando la parte superior de un tetraedro pero la parte inferior del otro.
Ejercicio\(\PageIndex{4}\)
Epidota contiene solo uno de cada uno de sus cuatro aniones diferentes en su fórmula.
- Escribir la fórmula, con la carga apropiada, para cada uno de sus aniones. Tenga en cuenta que los átomos de oxígeno en los iones hidróxido (OH) y óxido (O) tienen cada uno un octeto.
- Epidote también contiene dos iones Ca 2+ en su fórmula, pero cantidades variables de Fe 3+ y Al 3+. ¿Cuánto hierro y aluminio, total, tiene en su fórmula?
- Respuesta a:
-
Los aniones son nesosilicato (4 -) + sorosilicato (6 -) + óxido (2 -) + hidróxido (1 -). El cargo total es de 13 -.
- Respuesta b:
-
El calcio es un metal alcalinotérreo, a dos átomos del borde izquierdo de la tabla periódica. Los dos calcios equilibrarían parcialmente esa carga con 2 x 2 + = 4 + carga; la carga neta es ahora 13 - + 4 + = 9 -.
Si cada Al o Fe tiene carga 3 +, entonces el número necesario para equilibrar la carga es de 9 + /3 + = 3 iones Fe/Al.
Ejercicio\(\PageIndex{5}\)
Utilice sus herramientas de dibujo tridimensionales (líneas, cuñas y guiones) para mostrar las dos conformaciones diferentes de sorosilicato a través de estructuras de Lewis.
Ni los nesosilicatos ni los sorosilicatos son sólidos de red. En realidad son solo familias de sólidos iónicos. Sin embargo, al observar la relación entre el ion nesosilicato y el ion sorosilicato, podemos ver por qué muchos silicatos empiezan a parecerse más a sólidos de red. Si uno de los átomos de oxígeno se puede compartir entre dos unidades de silicato, tal vez más también puedan.
Inosilicatos
Si dos unidades de silicato pueden compartir un oxígeno, más también pueden. De hecho, se pueden formar silicatos de cadena larga. Para ello, dos de los oxígenos en una unidad de silicato tienen que ser compartidos con otras dos unidades de silicato. Lo mismo ocurre en la siguiente unidad, y así sucesivamente, formando una cadena larga. Los materiales que contienen estos silicatos de cadena larga se denominan inosilicatos (silicatos “tendones” o “cuerdas”). A continuación se muestra el dibujo poliédrico de una sección de ión inosilicato.

Los inosilicatos no son exactamente sólidos de red porque no forman redes tridimensionales. Sin embargo, al menos en una dirección, están unidos covalentemente y pueden extenderse indefinidamente. Podría haber cientos de unidades de silicato seguidas. En cierto sentido, los inosilicatos también podrían describirse como polímeros. Contienen unidades individuales que siguen repitiéndose a lo largo de la cadena. En el dibujo poliédrico, las unidades repetitivas son simplemente tetraedros.
La cadena de inosilicato dibujada anteriormente ilustra una consideración importante que tiene en común con los sólidos de la red. Todos los sólidos de la red son diferentes en el interior que en el exterior. Podemos ilustrar esa diferencia en la cadena de inosilicato porque es una estructura relativamente simple. En la cadena de inosilicato, cada tetraedro a lo largo de la cadena se parece al siguiente, pero los del extremo son diferentes. Sólo están apegados a un vecino, no a dos. En comparación con las otras unidades repetitivas, estas tendrán un oxígeno extra con una carga negativa.
Extendiendo esa idea a los sólidos de red, en los que los enlaces covalentes se extienden en tres direcciones, encontraremos un problema similar a medida que salgamos del centro del sólido y alcancemos la superficie. La estructura en la superficie será diferente de la estructura en el interior del sólido, porque nos quedaremos sin átomos a los que seguir conectándonos.
- Los sólidos de red tienen diferentes estructuras en la superficie del material que en el interior del material.
- La superficie del material debe tener grupos ligeramente diferentes presentes debido a que la red ha llegado a su fin.
Uno de los inosilicatos más importantes es la wollastonita, la cual se utiliza en una serie de industrias. La wollastonita es un mineral blanco brillante en el que el contraión para el inosilicato es el ion calcio, Ca 2+. Se agrega a las baldosas cerámicas, pinturas y plásticos, en parte porque aumenta su durabilidad y resistencia. A veces se usa para hacer pastillas de freno para autos; proporciona fricción cuando se presiona contra el rotor, ralentizando las ruedas de tu auto, pero por su durabilidad no se desgasta demasiado rápido.
Ejercicio\(\PageIndex{6}\)
Convertir el dibujo poliédrico del ion inosilicato en una estructura de Lewis. Puedes parar después de cinco unidades repetitivas.
Ejercicio\(\PageIndex{7}\)
Mirando la estructura de Lewis para el ion inosilicato, ¿cuántos iones de calcio acompañarían a cada unidad repetitiva en Wollastonita?
Ejercicio\(\PageIndex{8}\)
En su estructura Lewis para iones inosilicato, circule las unidades de repetición. Proponer una fórmula para la Wollastonita.
Ejercicio\(\PageIndex{9}\)
Sugerir una razón por la que la Wollastonita podría conferir resistencia a la cerámica y otros materiales.
Ciclosilicatos
Si las unidades de silicato pueden formar cadenas, no debería sorprender que también puedan formar otras formas. Por ejemplo, las unidades de silicato pueden envolverse para formar anillos. Vienen en veriety de diferentes tamaños. Estos tipos de silicatos se denominan ciclosilicatos (silicatos de “rueda”).
Uno de los grupos minerales de ciclosilicato más familar es la familia del berilo. El miembro más destacado de la familia es la esmeralda. Contiene el anión cíclico que se muestra a continuación.
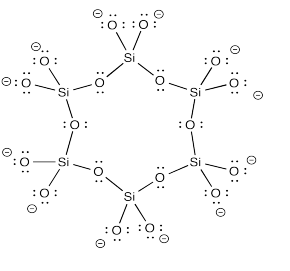
La forma poliédrica es una estrella preciosa.

Todos los berilos tienen el mismo anión ciclosilicato. Incluso tienen los mismos contraiones, con la fórmula general Be 3 Al 2 (Si 6 O 18). Sin embargo, los berilos vienen en diferentes colores debido a pequeñas cantidades de impurezas catiónicas. En esmeralda, una pequeña cantidad de ion cromo proporciona el color verde. En la aguamarina estrechamente relacionada, una pequeña cantidad de Fe 2+ da como resultado un azul pálido; sin embargo, cuando Fe 3+ está presente, el mineral es amarillo, en cambio.
Ejercicio\(\PageIndex{10}\)
La gema del estado de California, la benitoita, contiene un anión de ciclosilicato con solo tres átomos de silicio en ella.
- Dibuja la estructura Lewis de este ciclosilicato.
- Dibujar la representación poliédrica de este ciclosilicato.
- Este anión va acompañado de un bario y un ion titanio. Dados sus lugares en la tabla periódica, ¿cuál es el cargo probable en cada catión?
Claramente hemos vuelto de nuevo desde el borde de los sólidos de la red. Estos aniones pueden ser grandes, pero desde luego no se extienden una y otra vez en ninguna dirección. Sin embargo, anteriormente, observamos silicatos de una sola unidad y los extendimos a dobles, luego los unimos para hacer cadenas más largas. ¿Qué pasaría si pudiéramos unir algunos ciclosilicatos?
En lugar de obtener una cadena unidimensional, obtendríamos una red bidimensional.
Filosilicatos
El nombre “filosilicatos” significa, aproximadamente, “hoja” -silicatos. Estos aniones son láminas u hojas en las que los silicatos se unen entre sí para hacer redes bidimensionales. La estructura que se muestra a continuación se extendería a través de la parte superior, inferior y laterales de la página (o la pantalla).

Los ejemplos más familiares de filosilicatos son la familia de la mica. Si alguna vez has visto mica, con sus láminas delgadas, puedes imaginar fácilmente cómo estaría compuesta por redes bidimensionales como la anterior. Una de las aplicaciones más interesantes de la mica fue su uso como “vidrio Moscovy” en los viejos tiempos en Rusia. Sus capas delgadas y transparentes hicieron muy buenas ventanas.
Las micas son un ejemplo un poco más complicado de filosilicatos porque también son aluminosilicatos. Es decir, contienen aluminio así como silicio dentro de su red extendida de óxido.
Otro ejemplo familiar es el crisotilo, que es uno de los muchos minerales que consideramos como “amianto”. Comúnmente se le llama “asbesto blanco” y representa la gran mayoría de la minería de asbesto en el mundo. El crisotilo tiene la fórmula Mg 3 (Si 2 O 5) (OH) 4.
Ejercicio\(\PageIndex{11}\)
Considera la fórmula para el crisotilo.
- ¿Cuál es la carga habitual sobre un ion magnesio, dado su lugar en la tabla periódica?
- ¿Cuál es la carga sobre el ion hidróxido?
- El ion filosilicato se escribe como Si 2 O 5, representando la relación global de esos dos átomos en la estructura, pero claro que no viene en unidades de ese tamaño. ¿Cuál es la carga negativa total por unidad Si 2 O 5?
- ¿En qué se traduce eso en términos de carga negativa por unidad individual de silicato (es decir, una unidad individual de silicato por átomo de silicio)? Explique si eso tiene sentido en términos de la estructura poliédrica para un filosilicato mostrado anteriormente.
Durante décadas, el crisotilo fue apreciado por sus cualidades naturalmente aislantes y resistentes al fuego. Se usaba comúnmente en hogares y otros edificios hasta que nos dimos cuenta de que produce un polvo cancerígeno. Por lo general, el peligro de este polvo solo surge de la exposición repetida durante la extracción del amianto y la fabricación de productos que contienen amianto. Sin embargo, también podría ser un problema a largo plazo debido al polvo producido durante los proyectos de renovación de edificios.
Otras formas menos comunes de amianto incluyen “amianto azul” o crocidolita, con fórmula Na 2 Fe II 3 Fe III 2 Si 8 O 22 (OH) 2, y amosita gris a marrón, (Mg, Fe) 7 Si 8 O 22 (OH) 2.
Tenga en cuenta que existen algunas complicaciones en la forma en que se escriben estas fórmulas. Hay dos tipos diferentes de iones de hierro en la crocidolita. Uno es un ion Fe 2+ y el otro es un ion Fe 3+. A menudo, en estructuras y fórmulas, las cargas sobre los iones metálicos se denotan por el “estado de oxidación”, un número escrito con números romanos. De ahí que Fe II significa Fe 2+ en este contexto y Fe III significa Fe 3+.
La fórmula para la amosita en realidad está sugiriendo algo que hemos visto antes. En la amosita, los iones de hierro y magnesio pueden reemplazarse fácilmente entre sí en la estructura. En este caso, los iones son Mg 2+ y Fe 2+. El (Mg, Fe) solo significa que necesitamos alguna combinación de estos iones para un total de siete iones.
Sin embargo, la crocidolita y la amosita son en realidad ejemplos de inosilicatos en lugar de filosilicatos. Son un poco diferentes a los inosilicatos que vimos antes, sin embargo. En lugar de contener cadenas simples de polisilicato, estos materiales contienen cintas dobles de polisilicato.

En la imagen, la cinta de inosilicato se extiende por la parte superior e inferior de la página (o la pantalla) pero no hacia los lados.
Si alguna vez has visto asbesto, que es un mineral fibroso (un poco como un grupo de pelo largo), tal vez puedas imaginar una conexión entre estas estructuras y la apariencia física del mineral.
Ejercicio\(\PageIndex{12}\)
Proporcionar fórmulas para los miembros finales de la familia amosita.
Los tectosilicatos (silicatos “constructivos”) forman marcos tridimensionales.
En los sorosilicatos, la unidad individual de silicato comparte oxígenos con sus vecinos a través de una de las esquinas de sus tetraedros. En los inosilicatos, la unidad individual de silicato comparte oxígenos con sus vecinos a través de dos de las esquinas de sus tetraedros. En filosilicatos, unidades individuales de silicato comparten oxígenos con sus vecinos a través de tres de las esquinas de sus tetraedros.
En los tectosilicatos, la unidad individual de silicato comparte oxígenos con sus vecinos a través de cuatro de las esquinas de sus tetraedros.
Estas estructuras son bastante complicadas y generalmente incluyen aluminio así como óxidos de silicio. No obstante, a continuación se muestra un dibujo idealizado de tal red.
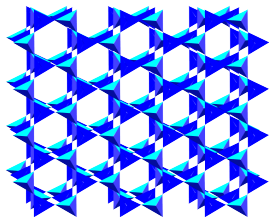
La idea del dibujo es que la estructura de silicato se extiende en dos dimensiones como los filosilicatos, pero también en una tercera dirección, uniéndose a tetraedros adicionales por encima y por debajo del plano del dibujo.
Sílice
La sílice es verdaderamente un sólido de red covalente. Su fórmula es SiO 2. A diferencia de los silicatos, que son aniones, es un compuesto neutro, por lo que no necesita contraiones para equilibrar una carga. Al igual que los tectosilicatos, forma una red tridimensional, con una unidad individual de silicato que comparte un oxígeno con sus neghbores a través de las cuatro esquinas del tetraedro.
Aunque es un sólido extendido tridimensional, es útil buscar subestructuras dentro de la red, así como es útil para identificar células unitarias de sólidos iónicos. En sílice, surge un patrón siguiendo “cadenas” de tetraedros de sílice a través de la red. A medida que seguimos de un tetraedro al siguiente, nos encontramos con un patrón en espiral en el que cada tetraedro se tuerce en relación con el anterior a él. Eventualmente, cada cuarto (o en algunos casos, séptimo) tetraedro se hace eco del original y el patrón se repite.
Esta forma de espiral es una reminiscencia del ADN. Al igual que el ADN, las cadenas dentro de la estructura tridimensional forman hélices. Podrían formar hélices diestras o hélices zurdas. Como resultado, la sílice es un material “quiral” y es “ópticamente activo”, temas que se tratan en la estereoquímica.

Al igual que en otros sólidos de red, la sílice debe tener una estructura diferente en su superficie que en el interior. En la superficie, no hay más unidades individuales de silicato con las que formar enlaces.
En cambio, los átomos de oxígeno colgando pueden formar enlaces covalentes con el hidrógeno, de manera que la superficie está cubierta con grupos OH. También pueden permanecer como iones siloxide tal como lo hacen en los silicatos; en ese caso, podrían tener contraiones como sodio o potasio.
Sin embargo, en comparación con el grueso interior del sólido, la superficie contribuye muy poco a la masa total del material. Como resultado, estos hidrógenos y sodios adicionales no están incluidos en la fórmula de sílice. En realidad, la verdadera fórmula de una muestra de sílice podría ser algo así (solo un ejemplo ficticio para enfatizar la idea):
\[\ce{Si1,022,000,000,000,000,000,000O2,044,000,000,000,000,000,000H36Na42} \nonumber\]
pero nadie jamás escribiría eso. El material es una millonésima parte por ciento de hidrógeno, una millonésima parte de un porcentaje de sodio, aproximadamente 66.7% de oxígeno y aproximadamente 33.3% de silicio. Está bastante maldito cerca de SiO 2.
El sílice es un material muy común. Su forma pura más familiar es el cuarzo. Además de encontrarse como cristales grandes, las partículas microcristalinas de cuarzo se encuentran en una amplia furia de otros minerales. También es el componente principal de la arena.
Ejercicio\(\PageIndex{13}\)
El circón es un nesosilicato que contiene iones Zr 4+. ¿Cuál es su fórmula?
Ejercicio\(\PageIndex{14}\)
Proponer una fórmula para una inosita simple y monocatenaria que contenga únicamente contraiones de sodio.
Ejercicio\(\PageIndex{15}\)
La jadeíta es un hermoso mineral verde; las piedras de alta calidad son una de las formas de la piedra preciosa, el jade. La jadeíta es una inosita simple de cadena sencilla que contiene números iguales de contraiones Na + y Al 3+. Proponer una fórmula para este mineral.

