10.4: Aluminosilicatos
- Page ID
- 80626
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los aluminosilicatos son compuestos que contienen óxidos tanto de silicio como de aluminio. Estos compuestos son bastante comunes en la corteza terrestre, por lo que vale la pena echar un vistazo a algunos ejemplos. Dos de los tipos más prevalentes son los filosilicatos, con estructuras extendidas en capas, y los tectosilicatos, con estructuras que se extienden a través de una red tridimensional de enlaces covalentes.
Filosilicatos
Los minerales arcillosos son una clase de aluminosilicatos estratificados formados por la meteorización de otros minerales de silicato. Probablemente estés familiarizado con la arcilla de alguna forma u otra. Es de grano mucho más fino que la arena, que es otro producto de la intemperie que comúnmente se encuentra en el suelo o se expone en las playas. A diferencia de la arena, la arcilla a veces se puede formar en formas. Vamos a echar un vistazo a dos ejemplos importantes.
El primer ejemplo, la caolinita, es el componente principal del caolín, una arcilla que es muy utilizada en la fabricación de “china” y otras cerámicas. Por lo general es blanco pero pequeñas cantidades de hierro pueden hacer que sea rosa, amarillo o naranja. El caolín contiene capas hexagonales de tetraedros de silicato, como hemos visto en otros filosilicatos. La diferencia es que esta capa se asienta sobre una capa de octaedros de aluminato, con algunos de los oxígenos compartidos entre las dos capas.
En la imagen de abajo, las líneas están destinadas a reforzar la idea de las geometrías involucradas: los tetraedros están delineados en azul y los octaedros están delineados en verde. No se muestran los enlaces entre silicio y oxígeno, ni los enlaces entre aluminio y oxígeno. Hemos mostrado los tetraedros en la parte superior y los octaedros abajo pero realmente no hay parte superior ni inferior a la capa, por lo que se puede dibujar con la misma facilidad al revés.
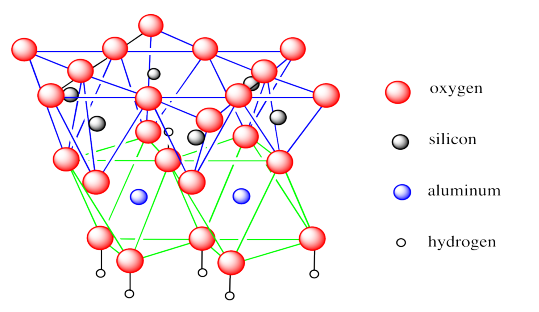
La caolinita es un ejemplo de lo que a veces se llama un mineral de arcilla 1:1 o un mineral de arcilla T-O. Estas designaciones transmiten la idea de que hay una capa tetraédrica y una capa octaédrica unidas entre sí por átomos de oxígeno compartidos.
Si le echas un vistazo a la estructura, verás que algunos de los átomos de oxígeno están unidos a hidrógenos; son hidróxidos. Estos hidróxidos juegan un papel importante en la estructura de largo alcance del caolín.
En la imagen de abajo, hemos simplificado el dibujo estructural a una caricatura. También hemos ampliado la vista para ver secciones transversales de dos láminas de filosilicato y ver un poco más abajo de cada lámina.
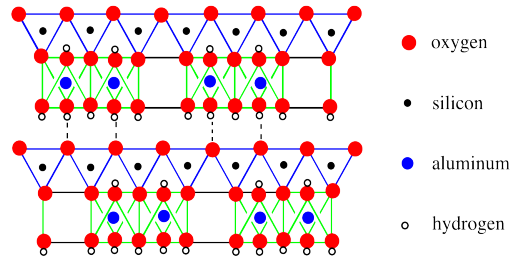
En el dibujo, la capa basal de hidróxidos (es decir, la capa de grupos OH en la cara inferior de una lámina) interactúa con la capa basal de óxidos en la siguiente lámina (esa es la capa de óxidos en la parte superior de la lámina). Estas láminas se mantienen unidas a través de enlaces de hidrógeno. Por supuesto, hay más hojas que eso. Se podría imaginar fácilmente una tercera capa por encima de las que se muestran, con sus hidróxidos basales enlazando hidrógeno con los oxígenos de la capa tetraédrica en la parte superior del dibujo.
La otra característica que es evidente en este dibujo es que la estructura de largo alcance de la capa varía un poco. Faltan algunos de los octaedros. Solo 2/3 de los posibles sitios en el octaédrico están realmente ocupados, aunque no necesariamente están espaciados uniformemente como en el dibujo. Hay otros minerales arcillosos que no tienen estas ausencias, aunque aquí no vamos a ver ninguno.
Una de las características únicas de la caolinita es una capa eléctricamente neutra. Si consideráramos que todos los oxígenos son O 2-, con los cationes Si 4+, Al 3+ o H + basados en las posiciones de estos átomos en la tabla perioidc, entonces las cargas positivas y negativas se equilibrarían exactamente entre sí. Eso contrasta con lo que veremos en los otros casos que veremos.
Ejercicio\(\PageIndex{1}\)
La caolinita tiene una fórmula general Al 2 Si 2 O 5 (OH) 4. Demostrar que la caolinita es electrónicamente neutral en general.
La montmorillonita es un ejemplo de otro tipo de mineral arcilloso. Es importante como aditivo para suelos en jardines porque ayuda con la retención de humedad. También se utiliza en la industria petrolera cuando se perfora petróleo; una suspensión de montmorillonita en el agua ayuda a mantener la broca fría.
La estructura, que se muestra a continuación, tiene mucho en común con la caolinita.
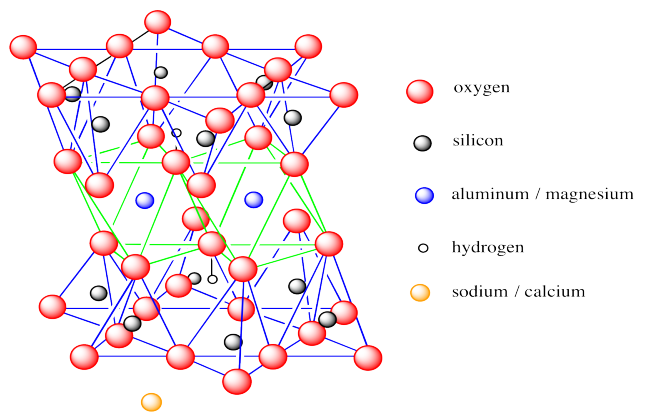
Sin embargo, existen algunas diferencias clave. La monmorillonita es un mineral de arcilla 2:1 o un mineral de arcilla T-O-T. Su capa octaédrica está intercalada entre dos capas tetraédricas. Además, hay menos grupos hidróxido en la monmorillonita que en la caolinita; ambas capas basales son óxidos, encontrándose hidróxidos solo en el interior de la capa. Finalmente, la montmorillonita no forma capas eléctricamente neutras. La capa es aniónica en general, requiriendo contraiones para equilibrar la carga. Estos iones suelen ser Na +, pero también incluyen Ca 2+.
Una visión más extendida de la monmorillonita revela una vez más la ausencia de un tercio de los octaedros de aluminato, así como algunas otras diferencias sutiles.
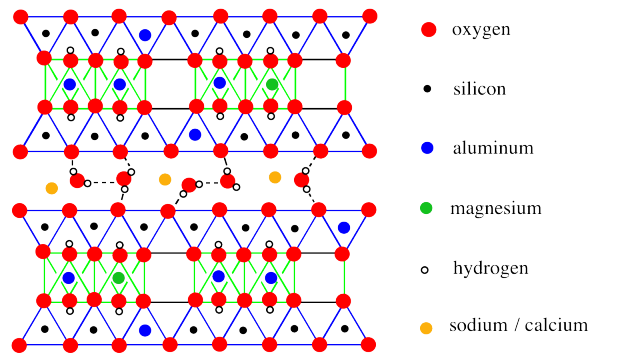
La diferencia más obvia es la presencia de moléculas de agua entre las capas. Esa diferencia es una característica clave de las propiedades de la montmorillonita. Sin embargo, la estructura a largo plazo también revela sustituciones ocasionales, en las que un magnesio ha reemplazado a un aluminio en un sitio octaédrico, o un aluminio ha reemplazado a un silicio en un sitio tetraédrico.
La capacidad de retención de humedad de la montmorillonita está relacionada con el cojín de moléculas de agua entre las capas del material. Siempre se puede permitir la entrada de más agua. 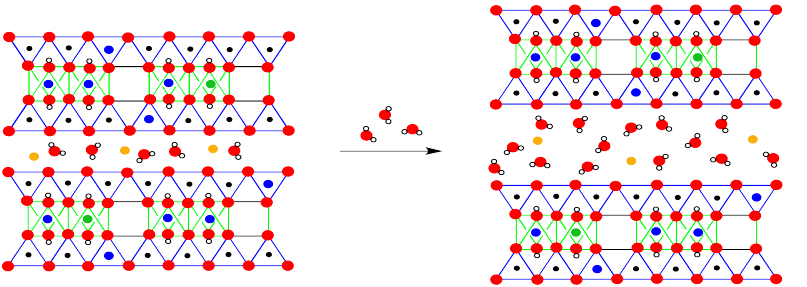
Ejercicio\(\PageIndex{2}\)
Predecir el efecto de las siguientes sustituciones sobre la carga de una lámina de montmorillonita.
- Un silicio es reemplazado por un aluminio.
- Un aluminio es reemplazado por un magnesio.
Ejercicio\(\PageIndex{3}\)
Los alfareros y ceramicistas normalmente no usarían arcilla montmorillonita en su trabajo. Explique por qué.
Las micas proporcionan ejemplos adicionales de flosilicatos. La forma más común de mica es la moscovita, que en un momento se utilizó en ventanas rusas. Tiene una apariencia muy distintiva, formando bloques que se pueden despegar en láminas delgadas y sólidas de material transparente.
La moscovita no es un mineral arcilloso. No se forma a partir de la meteorización de otras rocas. Sin embargo, claramente tiene algunas similitudes estructurales con los minerales arcillosos, especialmente con la montmorillonita.
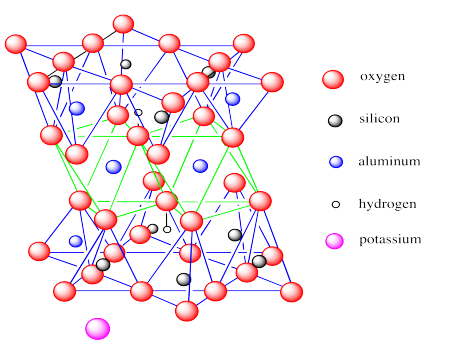
Al igual que la montmorillonita, las láminas de moscovita contienen capas octaédricas intercaladas entre capas tetraédricas. También, hay algunas sustituciones de aluminio por silicio en la capa tetraédrica.
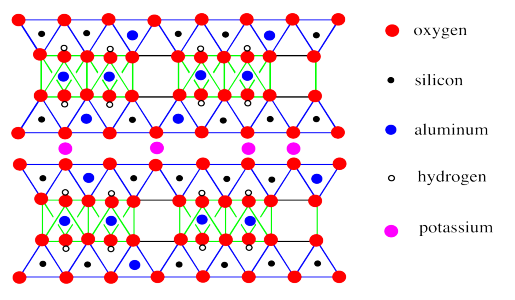
Una diferencia notable entre montmorillonita y moscovita es la ausencia de moléculas de agua entre capas en la mica. En cambio, el espacio entre las láminas está ocupado únicamente por iones de potasio.
Ejercicio\(\PageIndex{4}\)
¿Qué interacción mantiene unidas las láminas de moscovita?
Ejercicio\(\PageIndex{5}\)
¿Cómo se relaciona la estructura de la moscovita con la apariencia física del mineral?
Tectosilicatos
Una vez más, las estructuras de tectosilicato se vuelven muy complicadas y solo las veremos brevemente.
Uno de los grupos más comunes de aluminosilicatos son los feldespatos. Se piensa que constituyen alrededor del 50% de la corteza terrestre. Los feldespatos, como la sílice, tienen estructuras tridimensionales extendidas. Sin embargo, al igual que la sílice, podemos ver algunos patrones emergiendo siguiendo cadenas individuales de tetraedros a través de la estructura. En sílice, vimos espirales o hélices; en los feldespatos, vemos zig-zags en su lugar.

Los feldespatos son significativamente diferentes de la sílice debido a la frecuente sustitución de aluminio por silicio y porque sus estructuras contienen contraiones. Estos contraiones son frecuentemente potasio, sodio o calcio.
Ejercicio\(\PageIndex{6}\)
Los miembros finales del feldespato son feldespato potásico, albita y anortita. El feldespato potásico es el miembro terminal de potasio del grupo, KalSi 3 O 8. Determinar las fórmulas para:
- albita, el miembro final de sodio.
- anortita, el miembro final de calcio.
Los feldespatos son la clase más común de tectosilicatos, pero una de las clases más interesantes son las zeolitas. Las zeolitas son materiales tremendamente únicos y útiles. Se caracterizan por una gran capacidad para almacenar gases y pequeñas moléculas. De hecho, el nombre zeolita se traduce del griego para significar “piedras hirviendo”, porque pueden desprender vapor cuando se calientan. Las zeolitas también se utilizan en catálisis en la industria petrolera, ayudando a convertir los destilados de petróleo en formas más útiles.
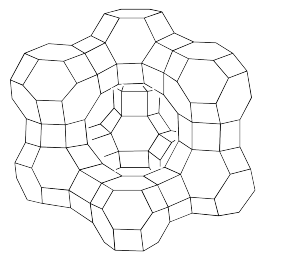
La razón por la que las zeolitas son capaces de almacenar moléculas pequeñas está directamente ligada a su estructura muy porosa, parecida a una jaula. Para enfatizar esa característica, las zeolitas se dibujan frecuentemente como dibujos lineales octaédricos. El siguiente boceto muestra la estructura de una faujasita, una zeolita natural que también se fabrica sintéticamente para fines industriales.
La estructura está truncada; se extendería aún más a través de la unión de unidades similares en diferentes direcciones. Sin embargo, esta vista nos permite ver algunas características clave. Una gran cavidad se ve claramente en el centro de la estructura. Además, hay cavidades más pequeñas dentro de los “globos” hexagonales en las esquinas, así como túneles a través de los “tambores” hexagonales que conectan los globos. Los hexágonos en sí son realmente aberturas en forma de poros en el interior de la zeolita.
A continuación se ilustra la conexión entre esta estructura poliédrica y la composición atómica de la faujasita. Allí, se han llenado los átomos alrededor de uno de los poros hexagonales.
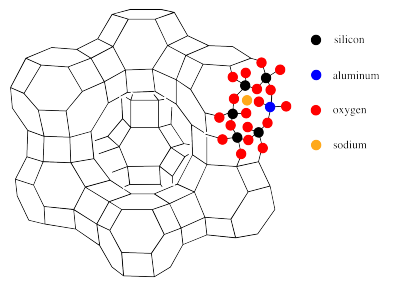
Cada vértice o esquina de la estructura representa un silicio. Sin embargo, el aluminio puede sustituir al silicio en grados variables. a lo largo de cada línea en el dibujo poliédrico hay un átomo de oxígeno. Así, los poros hexagonales en el dibujo son realmente anillos formados por doce átomos, no seis: seis siliconas (o aluminios) y seis oxígenos. También se ilustra en esta imagen la naturaleza aniónica de la estructura de zeolita, requiriendo la presencia de contraiones como el sodio.
Las zeolitas son útiles porque las moléculas pueden almacenarse dentro de ellas. Además, las moléculas pueden hacerse reaccionar entre sí mientras están atrapadas dentro de una zeolita a alta temperatura. Los investigadores están muy interesados en hacer nuevas arquitecturas de zeolitas, y en actualizarlas para contener sitios catalíticos que lleven a cabo reacciones importantes.
Las estructuras de las zeolitas pueden tener una especie de belleza arquitectónica. Sin embargo, existe una zeolita que se ha utilizado en el arte desde la antigüedad. Ultramarine es un pigmento azul profundo obtenido moliendo lapislázuli. El color característico proviene de aniones tiozónidos azules profundos (S 3 -) atrapados dentro de la estructura de la zeolita.

