11.8: Soluciones para problemas seleccionados
- Page ID
- 80414
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)\(\newcommand{\AA}{\unicode[.8,0]{x212B}}\)
Ejercicio 11.1.1:
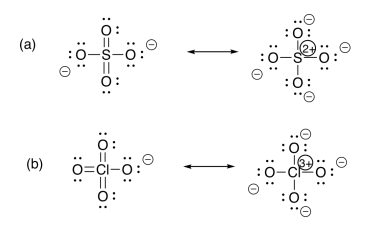
Ejercicio 11.1.2:
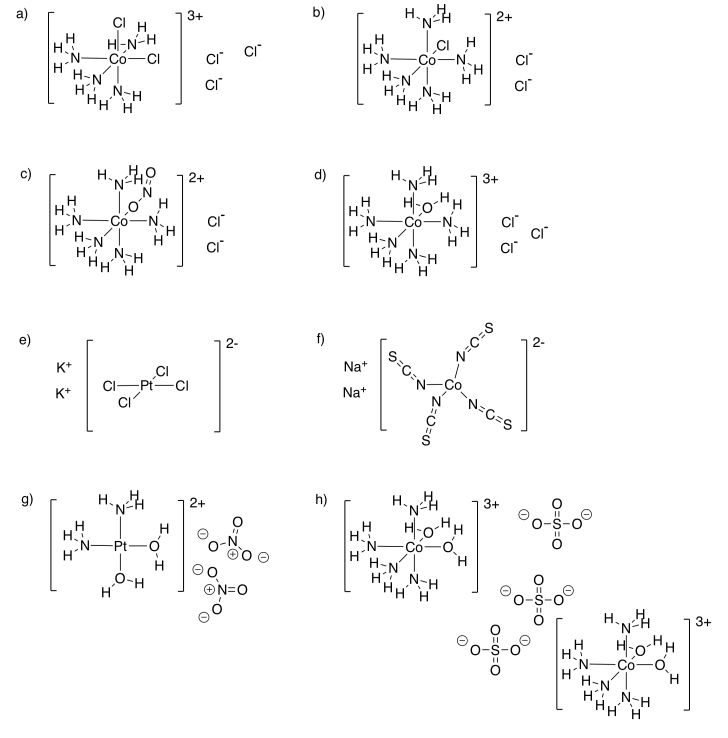
Ejercicio 11.2.1:
- Todos estos iones tienen la configuración electrónica del gas noble precedente, Ar. Estos metales acaban de comenzar a llenar los siguientes niveles de energía; estos electrones son relativamente altos en energía, con relativamente pocos protones que los atraen (en comparación con elementos posteriores en la fila). Los electrones de valencia son relativamente fáciles de usar, aunque no los electrones centrales.
- Estos metales tienen números relativamente altos de protones en comparación con los elementos a su izquierda en la misma fila. Tienen electronegatividad relativamente alta, por lo que no pierden muchos electrones.
- Estos metales en el medio muestran una mezcla de comportamientos: son lo suficientemente electronegativos para estabilizar cargas relativamente bajas, pero lo suficientemente lejos a la izquierda como para que puedan oxidarse completamente para alcanzar una configuración de gas noble.
Ejercicio 11.2.2:
- H 2 O = 0 carga; Fe (II) = 2+ carga; total = 2+
- H 3 N = 0 carga; Cl = 1- carga; Cr (III) = 3+ carga; total = 2+
- py = 0 carga; SCN = 1- carga; Mn (II) = 2+ carga; total = 0
- CN = 1- carga; Fe (II) = 2+ carga; total = 4-
- CN = 1- carga; CO = 0 carga; Co (III) = 3+ carga; total = 2-
- CN = 1- carga; NH 3 = 0 carga; Fe (II) = 2+ carga; total = 3-
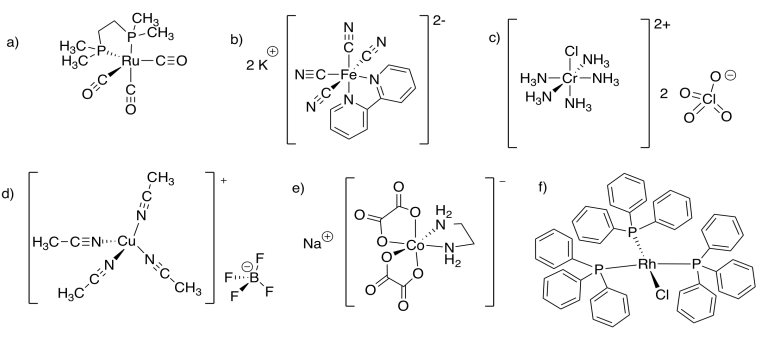
Ejercicio 11.2.3:
- Carga total = 3+; carga de ligandos = 0; carga en Cr = 3+
- Carga total = 3-; carga de ligandos = 6-; carga en Fe = 3+
- Carga total = 2+; carga de ligandos = 1-; carga en Cr = 3+
- Carga total = 4-; carga de ligandos = 6-; carga en Mn = 2+
- Carga total = 1+; carga de ligandos = 0; carga en Au = 1+
- Carga total = 0; carga de ligandos = 1-; carga en Ag = 1+
Ejercicio 11.3.1:
a)
| Pd valencia e - | 10 e - |
| cargar en complejo | 0 |
| carga sobre ligandos | 0 |
| cobrar en Pd | 0 |
| revisado Pd e - | 10 e - |
| e - donado por ligandos | 4 x 2 = 8 e - |
| total | 18 e - |
b)
| Cr valencia e - | 6 e - |
| cargar en complejo | 0 |
| carga sobre ligandos | 0 |
| cargar en Cr | 0 |
| revisado Cr e - | 6 e - |
| e - donado por ligandos | 6 x 2 = 12 e - |
| total | 18 e - |
c)
| Cu valencia e - | 11 e - |
| cargar en complejo | +1 |
| carga sobre ligandos | 0 |
| cobrar en Cu | +1 |
| revisado Cu e - | 10 e - |
| e - donado por ligandos | 4 x 2 = 8 e - |
| total | 18 e - |
d)
| Fe valencia e - | 8 e - |
| cargar en complejo | 0 |
| carga sobre ligandos | 0 |
| cobrar en Fe | 0 |
| revisado Fe e - | 8 e - |
| e - donado por ligandos | 5 x 2 = 10 e - |
| total | 18 e - |
e)
| Fe valencia e - | 8 e - |
| cargar en complejo | -4 |
| carga sobre ligandos | -6 |
| cobrar en Fe | +2 |
| revisado Fe e - | 6 e - |
| e - donado por ligandos | 6 x 2 = 12 e - |
| total | 18 e - |
Ejercicio 11.3.2:
a)
| Rh valencia e - | 9 e - |
| cargar en complejo | 0 |
| carga sobre ligandos | -3 |
| carga en Rh | +3 |
| revisado Rh e - | 6 e - |
| e - donado por ligandos | 5 x 2 = 10 e - |
| total | 16 e - |
b)
| Ni valencia e - | 10 e - |
| cargar en complejo | 2+ |
| carga sobre ligandos | 0 |
| cargar en Ni | 2+ |
| revisado Ni e - | 8 e - |
| e - donado por ligandos | 4 x 2 = 8 e - |
| total | 16 e - |
c)
| Cu valencia e - | 11 e - |
| cargar en complejo | 2+ |
| carga sobre ligandos | 0 |
| cobrar en Cu | 2+ |
| revisado Cu e - | 9 e - |
| e - donado por ligandos | 4 x 2 = 8 e - |
| total | 17 e - |
d)
| Pt valencia e - | 10 e - |
| cargar en complejo | 2- |
| carga sobre ligandos | 6- |
| cargar en Pt | 4+ |
| revisado Pt e - | 6 e - |
| e - donado por ligandos | 6 x 2 = 12 e - |
| total | 16 e - |
Ejercicio 11.4.1:
- en = bidentado; OH = monodentado
- dmpe = bidentado; bpy = bidentado; Cl = monodentado
- acac = bidentado; H 2 O = monodentado
- buey = bidentado; H 2 0 = monodentado
- dmpe = bidentado; H = monodentado
- H = monodentado; PPh3 = monodentado; OAc = bidentado. En este caso, el acetato consigue el complejo a 18 electrones uniendo dos veces.
- en = bidentado; Cl = monodentado
- bpy = bidentado; HOCH 2 CH 3 = monodentado
Ejercicio 11.4.2:
- Carga total = 1-; carga de ligandos = 4-; carga en Cr = 3+
- Carga total = 1-; carga de ligandos = 3-; carga en Mn = 2+
- Carga total = 1+; carga de ligandos = 2-; carga en Cr = 3+
- Carga total = 1+; carga de ligandos = 2-; carga en Co = 3+
- Carga total = 3-; carga de ligandos = 6-; carga en Mn = 3+
- Carga total = 3-; carga de ligandos = 6-; carga en Cr = 3+
- Carga total = 1-; carga de ligandos = 2-; carga en Au = 1+
Ejercicio 11.4.3:
- Cr = d 6; Cr 3+ = d 3; buey = 2 x 4e - = 8 e -; agua = 2 x 2e - = 4 e-; total = 15 e -
- Mn = d 7; Mn 2+ = d 5; acac = 3 x 4e - = 12 e -; total = 17 e -
- Cr = d 6; Cr 3+ = d 3; en = 2 x 4e - = 8 e -; Cl = 2 x 2e - = 4 e-; total = 15 e -
- Co = d 9; Co 3+ = d 6; en = 2 x 4e - = 8 e -; OH = 2e -; Cl = 2 e-; total = 15 e -
- Mn = d 7; Mn 3+ = d 4; buey = 3 x 4e - = 12 e -; total = 16 e -
- Cr = d 6; Cr 3+ = d 3; buey = 3 x 4e - = 12 e -; total = 15 e -
- Au = s 1 d 10; Au 1+ = d 10; bpy = 2 x 2e - = 4 e -; cianuro = 2 x 2e - = 4 e-; total = 18 e -
Ejercicio 11.5.1:
Ejercicio 11.5.2:
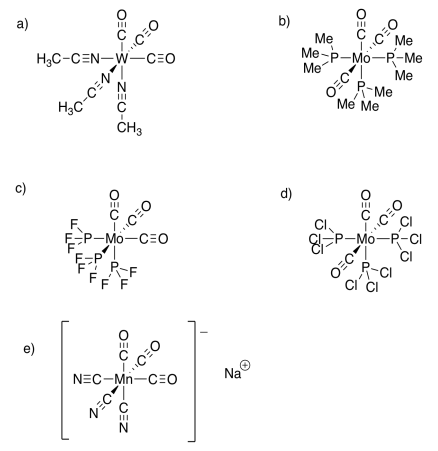
Ejercicio 11.6.1:
a) diaquabis (oxalato) cromato de potasio (III) b) nitrato de pentaaminabromocobalto (III) c) diclorobis (etilendiamina) cromo (III) hexafluorofosfato
d) bis (bipiridina) clorohidroxocobalto (III) perclorato e) triacuatriclorotitanio (III) f) hexacyanoferrato de potasio (III)
g) bipiridindicianoaurato de sodio (I)
La bipiridina a veces se llama “bipiridilo”.
Ejercicio 11.6.2: