13.2: Comportamiento Ondulado y Vinculación en la Molécula Hydrogren
- Page ID
- 80470
A principios del siglo XX, nuestra comprensión de la luz y la materia progresaba muy rápidamente, pero algunas cosas aún no tenían sentido para la gente. Las cosas realmente empezaron a hacer clic cuando varios físicos empezaron a pensar en las cosas de una manera diferente. Una de las cosas revolucionarias que hicieron fue tratar seriamente, con ecuaciones matemáticas, la naturaleza ondulada de la luz y la materia.
En el caso de la luz, la idea en realidad se remonta a mediados del siglo XVII. Christiaan Huygens, un relojero y astrónomo holandés, creía que la luz viajaba en ondas porque podía ver evidencia de patrones de interferencia en la luz, al igual que la forma en que las ondas en un estanque pueden interferir entre sí para producir nuevos patrones. Otros científicos, como Newton, realmente pensaban que la luz estaba hecha de pequeñas partículas. En cierto sentido, ambos tenían razón, y ahora pensamos que las partículas de luz, o fotones, tienen algunas de las propiedades de las ondas.
¿Qué sabemos de las olas? Las olas en la superficie de un lago o un océano son buenos ejemplos. Probablemente los echaste un vistazo detallado alrededor del sexto grado, aunque quizás hayas olvidado algunos de los detalles. Entonces, echemos otra mirada.
A lo mejor te has parado junto a un tanque de olas en un museo de ciencias y has visto algo que se parece a esto. La superficie del agua ondula hacia arriba y hacia abajo. Hay crestas donde el agua se amontona en cerros y abrevaderos donde el agua se desliza hacia los valles. En algún punto intermedio, hay un nivel promedio del agua, donde la superficie se asentaría si las cosas estuvieran tranquilas y no hubiera olas en absoluto.
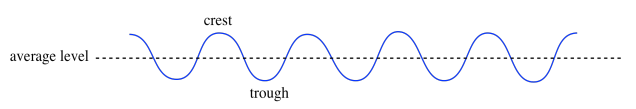
También podemos pensar que las olas tienen puntos nulos o nodos; esas son las posiciones a medio camino entre la cresta y el valle.
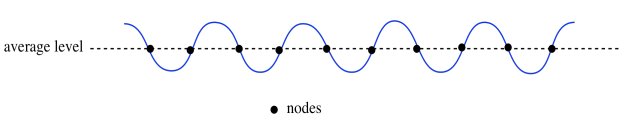
Max Planck y Albert Einstein echaron un vistazo más de cerca a esa idea a principios del siglo XX cuando intentaban determinar las relaciones entre los electrones en los materiales y su interacción con la radiación electromagnética. La radiación electromagnética incluye cosas como la luz ultravioleta y la luz visible.
Si estamos parados a la orilla del mar, una de las primeras cosas que notamos de las olas es lo altas que son. A lo mejor es un día muy tranquilo y las olas son casi planas. A lo mejor es un día muy difícil y las olas son muy altas. La característica de las ondas que estás notando se llama amplitud. Esa es la altura de la ola desde el nivel promedio del agua hasta la cresta, o, por el contrario, la profundidad hasta el abrevadero. En el mundo macroscópico, la amplitud de las olas es realmente importante. Necesitas saber si está bien pararse y ver las olas, o si se está poniendo demasiado áspero y debes buscar un terreno más alto. Si no tienes cuidado, una onda de amplitud muy alta podría caer sobre ti.
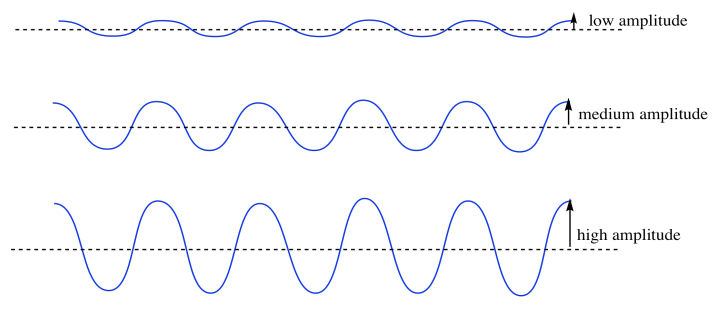
Las olas en el océano pueden tener gran amplitud o baja amplitud, y hay una consecuencia física. Las ondas sonoras también pueden tener alta amplitud (esas son las ruidosas) o baja amplitud (esas son las silenciosas). Por supuesto, si la amplitud fuera realmente, muy baja, casi no tendríamos ninguna onda (cuando esa persona está susurrando un secreto pero ni siquiera se puede escuchar).
En el mundo a nanoescala, el mundo de los fotones y electrones, la amplitud de una onda es algo mucho más sutil. No es nuestra primera consideración. Lo que es mucho más importante es la longitud de onda. La longitud de onda es solo la distancia de una cresta a la siguiente, o de una valle a la siguiente.
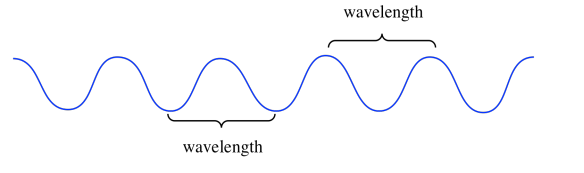
La longitud de onda es realmente importante porque, según el análisis de Planck y Einstein de los datos experimentales, es lo que determina la energía de un fotón individual, o la energía de un electrón individual. Cuanto más corta es la longitud de onda de un fotón o electrón, mayor es su energía. Cuanto más larga sea la longitud de onda de un fotón o electrón, menor será su energía. Esta relación es un ejemplo de proporcionalidad inversa: cuando uno se hace más grande, el otro se hace más pequeño.

Hay un atributo complementario de las ondas, y eso es la frecuencia. Podemos pensar en la frecuencia como la frecuencia con la que una ola cresta. Alternativamente, si imaginamos una onda electromagnética pasando por un objeto estacionario, la frecuencia describiría la frecuencia con la que una cresta pasa por el objeto. (Toda la luz viaja a la misma velocidad, aproximadamente 3 x 10 8 m s -1, así que no tenemos que preocuparnos de que eso sea un factor.)
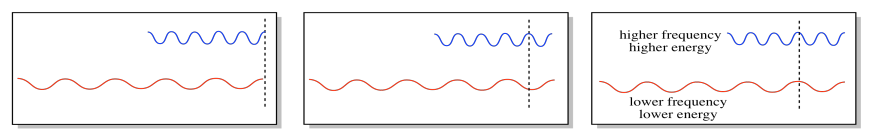
La frecuencia es inversamente proporcional a la longitud de onda: cuanto mayor es la longitud de onda, menor es la frecuencia. En consecuencia, la frecuencia es directamente proporcional a la energía del fotón o electrón. Cuanto mayor sea la frecuencia, mayor será la energía.
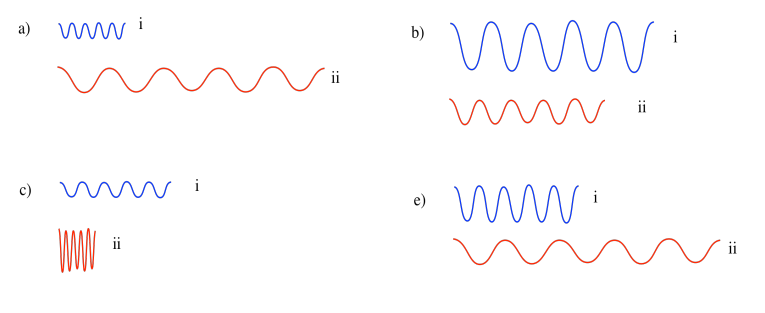
Ejercicio\(\PageIndex{1}\)
Entre cada par, ¿qué onda tiene mayor energía?
- Responder
-
En cada caso, la onda con mayor frecuencia y menor longitud de onda tendría la mayor energía. a) i; b) ii; c, ii; e) i.
Volvamos a la observación original de Christiaan Huygens sobre los patrones de interferencia en la luz. ¿Qué significa eso?
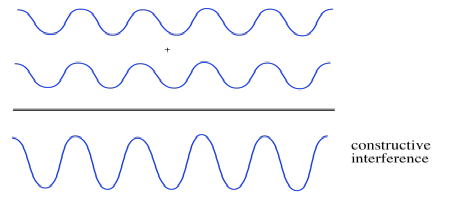
Supongamos que dos olas se juntan. Pensaremos en dos casos diferentes. En el primer caso, las dos ondas están en fase entre sí. Eso significa que ambos coronan al mismo tiempo y sus abrevaderos siempre están alineados, también. ¿Qué pasa entonces? Te imaginas que las crestas solo se construirán unas sobre otras, cada vez más altas, y los canales caerán entre sí, cada vez más profundos. La amplitud de las ondas, juntas, aumenta. Se trata de una interferencia constructiva.
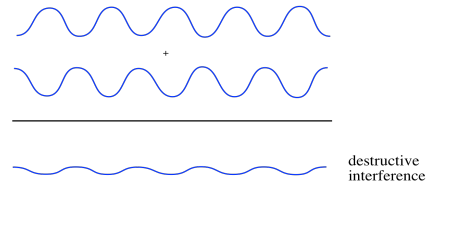
Ahora supongamos que las dos ondas están desfasadas. Cuando uno cresta, el otro toca fondo. En ese caso, la cresta de una ola cae en el canal de la otra. Todo se nivela. Esto es una interferencia destructiva.
La interferencia constructiva y la interferencia destructiva también ocurre con las olas en el agua. Eso lleva a muchos patrones de ondulación si arrojas dos piedras a un estanque quieto. Los fotones también pueden producir ese tipo de patrones, y también los electrones.
Lewis sugiere que dos átomos con electrones desapareados pueden compartir sus electrones para formar un enlace. En una estructura de Lewis, podemos dibujar esos dos electrones entre los símbolos de los dos átomos para mostrar que se ha formado un enlace. La mecánica cuántica ofrece una visión matemática cuantitativa de las moléculas, y se considera que proporciona una imagen precisa del comportamiento de átomos y moléculas. Ahora, en lugar de poner dos átomos uno al lado del otro y dejar que dos puntos se junten para formar un enlace, como en una estructura de Lewis, pensaremos en unir en términos mecánicos cuánticos.
- Dos átomos de hidrógeno se colocan uno al lado del otro.
- Los dos átomos están rodeados por las ondas formadas por sus electrones.
- Si los dos átomos están muy juntos, estas dos ondas se superponen entre los dos átomos.
¿Qué sucede cuando las ondas se superponen? Se desarrollan patrones de interferencia. Piensa en un estanque plano y tranquilo, en el que tú y un amigo lanzan dos pequeñas piedras, a unos pies de distancia. Las ondas resultantes se mueven en círculos desde los dos puntos donde cayeron las piedras, y cuando los dos conjuntos de olas se encuentran, resultan nuevos patrones. Los conjuntos circulares de ondas se combinan para formar nuevas olas con nuevas formas.
Cuando las olas se encuentran, hay dos combinaciones básicas que resultan. Estas combinaciones dependen de si las dos ondas están en fase o fuera de fase entre sí.
- Si las ondas están en fase, de manera que el pico de una ola aterrice sobre el pico de otra, y el valle de una onda coincida con el canal en la otra, se produce interferencia constructiva. Las olas se suman, y se hacen más grandes donde se superponen.
- Si las olas están exactamente desfasadas, el pico de una cae en el canal de otra, y donde se superponen las dos olas se cancelan. Esto es una interferencia destructiva.
Podemos aplicar estas ideas a los electrones en átomos que se unen para hacer un enlace. En las estructuras de Lewis, los electrones individuales en dos átomos diferentes se emparejan en un enlace entre los dos átomos. Los electrones tienen que combinarse para formar un enlace. Si los electrones tienen propiedades de onda, entonces habrá patrones de interferencia que resultarán cuando estos átomos se junten.
Antes de comenzar, tenga en cuenta que las olas con las que estaremos lidiando se ven un poco diferentes a las olas estacionarias que miramos antes. Estas ondas serán tridimensionales y ocuparán distintas regiones del espacio. En lugar de dibujar información de fase como picos y valles, vamos a utilizar una convención común de sombreado para significar si estamos mirando la parte positiva (en términos de fase) o la parte negativa de una onda. Por ejemplo, podríamos mostrar las crestas en azul y los canales en rojo, o podríamos mostrar una en negro y la otra en blanco. En una onda estacionaria, las fases se verían así:

En un átomo de hidrógeno, el electrón se encuentra en un área esférica alrededor del núcleo. No podremos ver dos fases distintas -una cresta y un valle- en esta ola a la vez. Sin embargo, podríamos ver dos átomos de hidrógeno diferentes e ilustrar si sus electrones están en fase o fuera de fase entre sí.

Cuando esos dos electrones se juntan y están en fase entre sí, se produce una interferencia constructiva. No se superponen por completo; estos son átomos y ocupan espacio. No obstante, podrán sentarse bastante cerca el uno del otro, algo así como aplastando sus electrones juntos. Esa interferencia constructiva sucederá en los medios, entre los átomos.
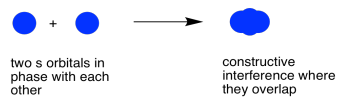
Cuando los dos electrones se juntan y están desfasados, se produce una interferencia destructiva. Nuevamente, eso sucederá en el medio, entre los átomos.
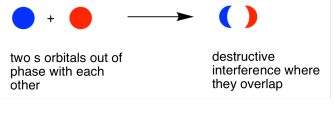
Entonces, en el par de átomos de hidrógeno, dos ondas pueden combinarse para producir dos posibles resultados.
- En uno, la altura de la onda combinada es más alta entre los dos átomos, donde se superponen y están en fase. La amplitud de la onda es mayor aquí.
- En el otro caso, la onda combinada está compuesta por dos mitades que están desfasadas, y no hay ninguna onda entre los dos átomos, donde han cancelado; la amplitud de esta onda es cero entre los dos núcleos.
Esas dos combinaciones posibles producen dos resultados diferentes. Realizamos un seguimiento de estos resultados utilizando un diagrama de interacción orbital molecular. El diagrama dice que los dos orbitales pueden combinarse de dos maneras diferentes: en fase o fuera de fase. El diagrama también nos dice que la combinación en fase da como resultado una disminución de la energía cuando los dos átomos se unen. La combinación fuera de fase da como resultado un aumento en la energía cuando los átomos se unen.
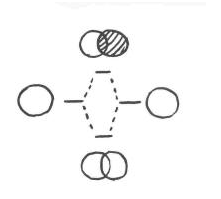
Figura\(\PageIndex{1}\): Diagrama de interacción orbital molecular para H 2. Un átomo de hidrógeno 1s orbital se muestra a la izquierda con su nivel de energía acompañante. Lo mismo se muestra a la derecha. En la mitad del diagrama, los dos orbitales de hidrógeno 1s se pueden combinar de dos maneras: en fase y fuera de fase. Estas combinaciones producen dos nuevos orbitales (o formas de onda de electrones) con dos nuevos niveles de energía.
¿Por qué la combinación en fase baja en energía, mientras que la combinación fuera de fase sube?
Considere la idea de que cada una de estas ondas tiene una longitud de onda, y que esta longitud de onda está relacionada con la energía cinética. Para el electrón 1s sobre un átomo de hidrógeno, realmente solo podemos visualizar la mitad de la onda; esta media onda es básicamente del tamaño de un átomo de hidrógeno, por lo que la longitud de onda total sería de dos átomos de hidrógeno de largo (a falta de un mejor patrón).
Para la combinación fuera de fase, podemos visualizar toda la onda, tanto su “pico” en un lado como el “canal” en el otro. Los dos átomos de hidrógeno no están simplemente sentados uno al lado del otro, en realidad se superponen, de modo que la distancia de un extremo de la onda al siguiente es en realidad algo menor que dos átomos de hidrógeno. Digamos que tiene una longitud y media de átomos de hidrógeno. Esta onda tiene una longitud de onda más corta que las ondas en cualquiera de los dos átomos de hidrógeno individuales, y así está a mayor energía.

Figura\(\PageIndex{2}\): Comparación de longitudes de onda observadas a lo largo del eje del enlace en dihidrógeno.
Para el caso en fase, nuevamente, los dos átomos de hidrógeno se superponen. Pero esta vez sólo podemos visualizar la mitad de la onda; así la longitud de onda total sería más larga que dos átomos de hidrógeno. A lo mejor son tres átomos de hidrógeno de largo. Esta onda tiene una longitud de onda más larga que el electrón en un átomo de hidrógeno individual, por lo que está a menor energía.
- La combinación de orbitales atómicos da como resultado nuevos orbitales moleculares.
- El número de orbitales atómicos combinados = el número de orbitales moleculares producidos.
- Son posibles combinaciones en fase (baja energía) y fuera de fase (alta energía).
Y ahora por la parte rara:
- Según la mecánica cuántica, las combinaciones dentro y fuera de fase ocurren simultáneamente.
¿A dónde irían realmente los dos electrones? El proceso aufbau utilizado para las configuraciones de electrones atómicos es cierto aquí. Se pueden encontrar dos electrones en el mismo espacio siempre que estén emparejados por espín; uno habría girado “arriba” y el otro giraría “hacia abajo”. Ambos electrones se pudieron encontrar en el orbital de menor energía. Eso significa que ambos electrones de hidrógeno bajan de energía cuando se forma H 2; la formación de una molécula de hidrógeno a partir de dos átomos de hidrógeno es, por lo tanto, exotérmica.
- El orbital ocupado se llama orbital de unión; es responsable de la energía de enlace en H 2.
- La energía de enlace se refiere a la cantidad de energía emitida cuando se forma un enlace.
¿Qué pasaría si cada átomo de hidrógeno trajera dos electrones con él? ¿Dos iones hidruro formarían un enlace?
- Habría cuatro electrones en una molécula H 2 -.
- Los dos primeros electrones ocuparían el orbital inferior de unión.
- Los dos siguientes electrones ocuparían el orbital superior
- En general, no habría pérdida neta de energía, por lo que no se formaría un bono.
- A la combinación desfasada se le llama orbital antienlace, ya que su aumento de energía desplaza la disminución de energía que se produce cuando los electrones entran en un orbital de unión.
- Colocar electrones en un orbital antienlace debilita o rompe un enlace.
¿Qué nos dice la mecánica cuántica sobre la unión que no podemos aprender de las estructuras de Lewis? Aprendemos que los electrones a veces pueden disminuir su energía cinética formando enlaces. Si ese es el caso, se formará la fianza. Por otro lado, si no se puede bajar la energía cinética, el enlace no se formará en absoluto.
- Los enlaces covalentes se forman porque los electrones pueden adoptar longitudes de onda más largas.
- Los electrones con longitudes de onda más largas tienen menor energía cinética.
Ejercicio\(\PageIndex{2}\)
Agrega algunas palabras para explicar las ideas que se transportan en estos dibujos.
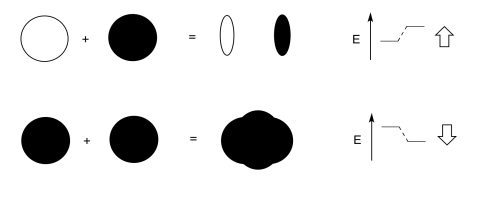
- Responder
-
Cuando los orbitales de dos s se combinan fuera de fase, se produce interferencia destructiva.
Hay un nodo entre los átomos.
La energía de los electrones aumenta.
Cuando los orbitales de dos s se combinan en fase, se produce interferencia constructiva.
No hay ningún nodo entre los átomos; los electrones se encuentran entre los átomos.
La energía de los electrones disminuye.

