1.1: Introducción
- Page ID
- 79543
Usamos energía todos los días. Enchufamos nuestros dispositivos electrónicos, extrayendo energía que se ha convertido en electricidad, pero que se originó en una cascada en una turbina que gira, un viento que convirtió un molino de viento, la quema de carbón para producir dióxido de carbono, una reacción nuclear, u otras fuentes. Conducimos automóviles, en los que la energía liberada de una reacción química calienta el gas en una cámara, empujando un pistón que impulsa un cigüeñal que finalmente hace que las ruedas giren.
Muchas de nuestras fuentes de energía dependen de procesos químicos. La energía solar, por ejemplo, depende de la fotoquímica. Cuando un fotón del sol es absorbido por un átomo del tipo correcto de material, un electrón salta de un nivel de energía a uno superior. Ese suceso deja atrás un “agujero”, un lugar donde solía estar un electrón. Un electrón podría entrar desde un átomo vecino para ocupar ese agujero. Ahora el electrón original no puede volver a caer de donde vino; en cambio tendrá que caer en un agujero en el siguiente átomo. Ahora tenemos electrones moviéndose de un átomo al siguiente. Tenemos electricidad.
La quema de gasolina y carbón depende de la expansión de gases que empujan contra una turbina, como el viento contra un molino de viento. Los gases se expanden porque se calientan más cuando ocurre la reacción de combustión, o quema. Pero, ¿por qué estas reacciones producen calor? Eso está relacionado con la formación de enlaces químicos. Cuando se forman enlaces químicos, se libera energía.
- La formación de un enlace químico siempre libera energía.
En el transcurso de una reacción química, con frecuencia se rompen los enlaces antiguos y se hacen con frecuencia otros nuevos. Pero si siempre se libera energía cuando se forman bonos, ¿qué sucede cuando se rompe un vínculo? Cuando se rompe un vínculo, se consume energía. Cuesta energía romper un vínculo, pero la formación de un nuevo bono devuelve algo de energía.
- Romper un enlace químico siempre cuesta energía.
Entonces, si romper bonos cuesta energía, y hacer bonos paga energía, y la energía se convierte en calor, entonces una reacción solo producirá calor si la energía liberada cuando se hacen los bonos es más que la energía consumida cuando se rompieron los bonos. Tenemos que sustituir los lazos más débiles por otros más fuertes.
Quemar compuestos que contienen carbono, como madera, carbón o gasolina, es una manera fantástica de liberar energía y producir calor. Nuestros antepasados lo han sabido desde la edad de piedra. Los compuestos que contienen carbono generalmente contienen muchos enlaces carbono-carbono y carbono-hidrógeno (que en realidad son bastante fuertes). Cuando se queman, producen dióxido de carbono y agua, que contienen enlaces carbono-oxígeno e hidrógeno-oxígeno, y esos enlaces son incluso más fuertes que los enlaces carbono-hidrógeno y carbono-carbono que se rompieron. En general, se libera energía.
Podemos usar esa energía para calentarnos en una noche fría bajo las estrellas, para cocinar nuestra comida, para conducir un molino que fabrica acero, o para volar un avión. Podemos usar esa energía para hacer el trabajo.
La termodinámica es el estudio de la relación entre el calor (o energía) y el trabajo. En otras palabras, la termodinámica mira cómo podemos poner energía en un sistema (ya sea una máquina o una molécula) y hacer que funcione. Alternativamente, podríamos hacer algún trabajo en un sistema y hacer que produzca energía (como hacer girar las turbinas en una central eléctrica para producir electricidad).
En química, a veces hablamos más ampliamente sobre la “energética” de las reacciones (en lugar de la termodinámica), porque la energía emitida durante una reacción puede simplemente perderse en el entorno sin hacer un trabajo útil. Sin embargo, las ideas son las mismas: se puede agregar energía a un conjunto de moléculas para producir una reacción, o puede ocurrir una reacción entre un conjunto de moléculas para liberar energía.
Un ejemplo clásico de la energía de reacción es la hidrólisis de ATP a ADP en biología. Esta reacción se utiliza en la célula como fuente de energía; la energía liberada de la reacción se acopla frecuentemente a otros procesos que no podrían ocurrir sin la energía añadida.
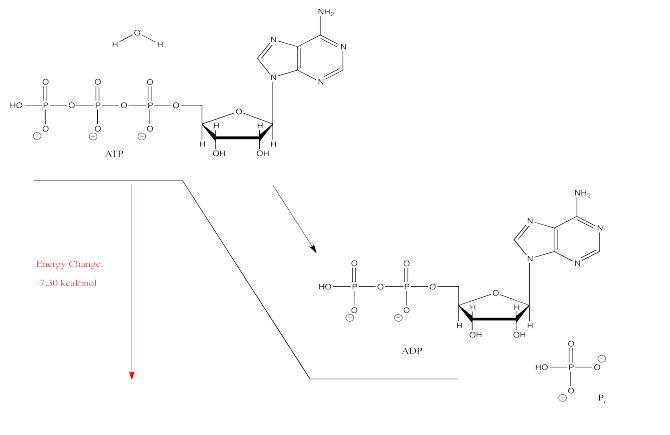
La hidrólisis de ATP, o la adición de agua a ATP para romper el ATP en dos moléculas más pequeñas, emite energía. Esa energía puede ser utilizada por la célula para llevar a cabo otros procesos que costarían energía. También se producen una molécula de ADP y una molécula de fosfato inorgánico, a veces abreviada como P i.
- La energía puede ser emitida por una reacción química.
- Esa energía puede ser utilizada para alimentar otras reacciones que requieran energía.
En la célula, el ATP se produce en niveles altos en las mitocondrias. Debido a que es una molécula relativamente pequeña, puede transportarse fácilmente a otras áreas de la célula donde puede ser necesaria la energía. El ATP se puede hidrolizar in situ, proporcionando energía para que la célula la use para otras reacciones.
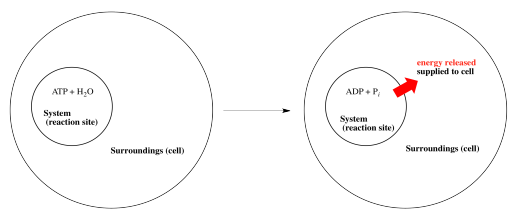
Tenga en cuenta que el esquema anterior utiliza alguna jerga termodinámica. El lugar donde tiene lugar la reacción, o las moléculas que participan en la reacción, se llaman “el sistema”. La energía se suministra a “los alrededores”, es decir, lugares o moléculas distintas de las directamente involucradas en esta reacción.
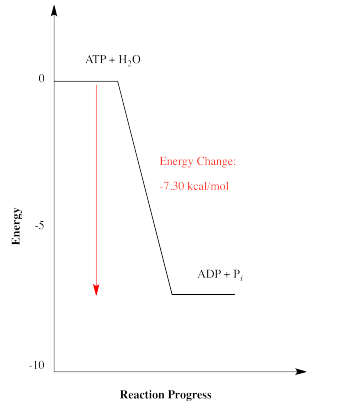
Hay un par de otras formas en las que comúnmente se representan las energías de las reacciones. La relación energética entre ATP más agua y ADP más fosfato mostrada anteriormente es realmente un gráfico simplificado de energía versus progreso de reacción (a veces llamado coordenada de reacción). Este tipo de gráfica muestra los cambios en la energía a lo largo del transcurso de una reacción. La energía del sistema al inicio de la reacción se muestra a la izquierda, y la energía al final de la reacción se muestra a la derecha. Este tipo de gráfica a veces se denomina perfil de reacción.
Otra forma común de discutir la energía es incluir la energía como reactivo o producto en una ecuación que describa la reacción. Una ecuación para una reacción muestra cuáles fueron los materiales de partida para la reacción y en qué se convirtieron después de la reacción. A las cosas que reaccionaron juntas en la reacción se les llama los “reactivos”. Están escritos en el lado izquierdo de la flecha que dice que se produjo una reacción. A las cosas en las que se convirtieron los reactivos se les llama los “productos”. Aparecen en el lado derecho de la flecha.
\[ATP \:+ \: H_{2}O \rightarrow ADP \: + \: P_{i} \: + \:energy \nonumber\]
Para la hidrólisis del ATP, la energía simplemente se incluye como uno de los productos de la reacción, ya que la reacción libera energía.
Alternativamente, la observación energética sobre ATP se puede dar la vuelta, ya que evidentemente hay algunas reacciones que cuestan energía. Probablemente la reacción más conocida de este tipo es la conversión del dióxido de carbono en carbohidratos como la glucosa. Esta conversión en realidad resulta de una larga serie de reacciones diferentes que ocurren una tras otra. En general, el proceso requiere mucha energía. Esta energía es suministrada en parte por ATP, generada con asistencia del fotosistema I y II, que son matrices de moléculas que interactúan con la luz solar. A continuación se muestra un perfil de reacción simplificado para la síntesis de carbohidratos.
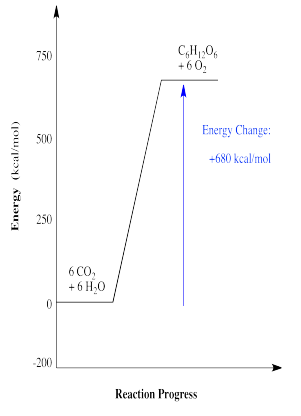
- La energía puede ser consumida por una reacción química.
- Las reacciones que consumen energía necesitan una fuente de energía para que se produzcan.
Nuevamente, esta relación energética puede pensarse en forma de reacción equilibrada.
\[energy \: + 6CO_{2} + 6H_{2}O \rightarrow \: C_{6}H_{12}O_{6} +O_{2} \nonumber\]
En este caso, la energía es un reactivo, no un producto. Es uno de los ingredientes clave necesarios para que la reacción suceda.
Las reacciones que producen energía, como la hidrólisis de ATP, se denominan reacciones exotérmicas (o a veces exergónicas, lo que significa más o menos lo mismo). En los perfiles de reacción, estas reacciones van cuesta abajo en energía ya que la reacción ocurre desde el lado izquierdo del diagrama hacia la derecha. Por otro lado, las reacciones que cuestan energía (las que van cuesta arriba en el perfil de reacción, como la síntesis de carbohidratos) se denominan endotérmicas (o a veces endergónicas).
Es útil pensar en las reacciones como “ir cuesta abajo” o “ir cuesta arriba” porque una de estas situaciones debería parecer inherentemente más fácil que la otra (especialmente si alguna vez has estado esquiando). Las reacciones exotérmicas (las de descenso) ocurren muy fácilmente; las reacciones endotérmicas no (esas son las de subida).
- Los sistemas siempre van a bajar la energía si es posible.
Las reacciones que son energéticamente “cuesta arriba” no pueden ocurrir fácilmente por sí mismas. Esas reacciones deben ser impulsadas por otras reacciones que van cuesta abajo. La energía intercambiada entre estas reacciones mantiene las reacciones químicas en funcionamiento, en las células y otros lugares importantes. En ocasiones, un proceso que se utiliza para suministrar energía para otra reacción es considerado como la “fuerza impulsora” de la reacción. Sin la fuerza impulsora, la reacción deseada no podría ocurrir.
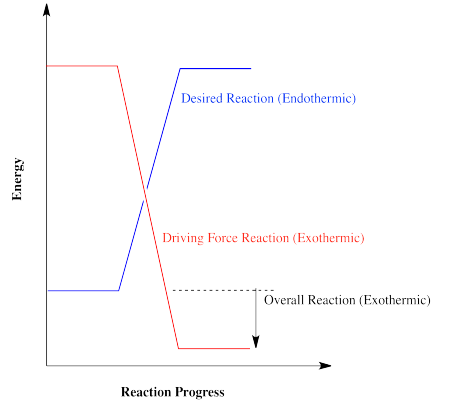
En general, se producirá una reacción si se suministra energía más que suficiente. El exceso de energía no duele en la escala macroscópica. Sin embargo, si no se suministra suficiente energía para compensar una reacción endotérmica, la reacción no es probable que ocurra.
La energía se parece mucho al dinero. Se puede pasar de un juego de manos a otro. Hacerlo a menudo ayuda a hacer las cosas.
Existe un problema con el uso de reacciones químicas como fuentes de energía. Si la hidrólisis de ATP libera energía, y si siempre se favorece la liberación de energía, ¿por qué no ocurre espontáneamente? En otras palabras, ¿por qué no todas las moléculas de ATP en todas las células de todos los organismos del mundo entero simplemente se deslizan cuesta abajo hacia el ADP ahora mismo? ¿Qué es lo que los detiene?
Afortunadamente, todas las reacciones tienen barreras que impiden que ocurran hasta que estén listas para irse. Una barrera de reacción es una inversión inicial de energía necesaria para comenzar las cosas. Las barreras de reacción ocurren por una variedad de razones físicas: dos moléculas pueden necesitar orientarse en la dirección correcta para reaccionar entre sí, o un enlace puede tener que romperse para poner en marcha la reacción, lo que cuesta un desembolso inicial de energía.
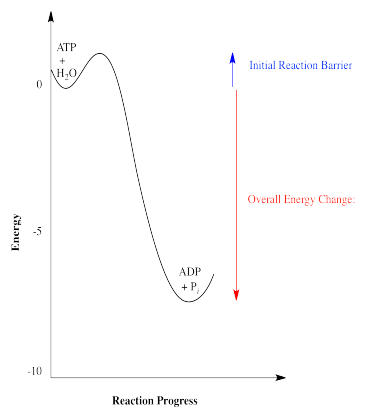
Las barreras de reacción de las reacciones influyen en la rapidez con que ocurren las reacciones. Las altas barreras ralentizan mucho las reacciones. Las barreras bajas permiten que ocurran con mayor facilidad. El estudio de las barreras de reacción, y la rapidez con que pueden ocurrir las reacciones, se denomina cinética química.
La termodinámica, por otro lado, está realmente preocupada por el cambio energético general desde el inicio de una reacción hasta el final. Compara las energías de dos conjuntos de moléculas entre sí: las energías de los reactivos y las energías de los productos.
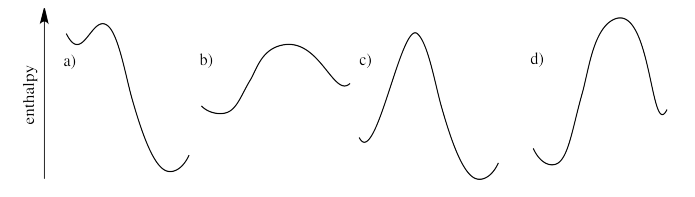
¿Cuál de los siguientes perfiles de reacción describe reacciones que van a seguir adelante, a diferencia de las que probablemente no ocurrirán?
- Contestar
-
Procederán reacciones que bajen en energía. Las reacciones que suben en energía no procederán. Si el perfil de reacción es mayor a la izquierda (lado reactivo) que a la derecha, la reacción avanzará y formará productos. Si lo contrario es cierto, la reacción presumiblemente no ocurrirá.

