3.28: ¿Qué es un nucleófilo?
- Page ID
- 79390
Muchas cosas pueden ser nucleófilos. En principio, un nucleófilo solo necesita un par solitario. Sin embargo, algunos nucleófilos son mejores que otros.
Ya sabes algo de nucleófilos si sabes algo de acidez y basicidad. Los nucleófilos son realmente bases de Lewis. Algunos de los factores que dan cuenta de la basicidad también explican la nucleofilia.
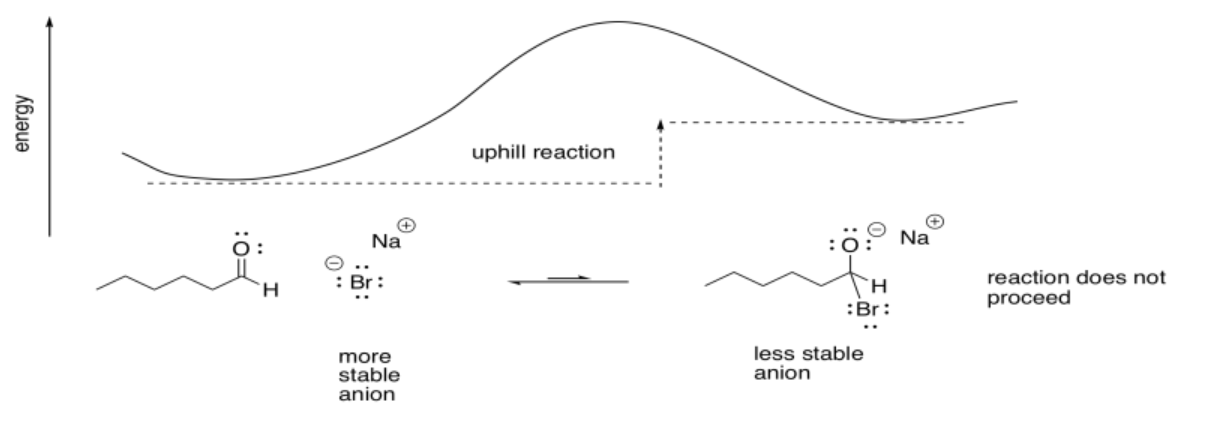
Los haluros no son muy buenos nucleófilos para los carbonilos. La carga negativa sobre un haluro es bastante estable, ya sea por electronegatividad o polarizabilidad. Si un haluro dona a un carbonilo, produciendo un anión de oxígeno, la reacción es cuesta arriba.
Los aniones hidróxido y alcóxido (como CH 3 O -) son más reactivos que los haluros. Son mejores nucleófilos. Los análogos de azufre son igualmente buenos nucleófilos (como CH 3 S -). Además, el agua, los alcoholes y los tioles son nucleofílicos, porque todos tienen pares solitarios que podrían ser donados a un electrófilo.
El nitrógeno también tiene un par solitario en la mayoría de los compuestos. Eso significa que las aminas también son buenos nucleófilos.
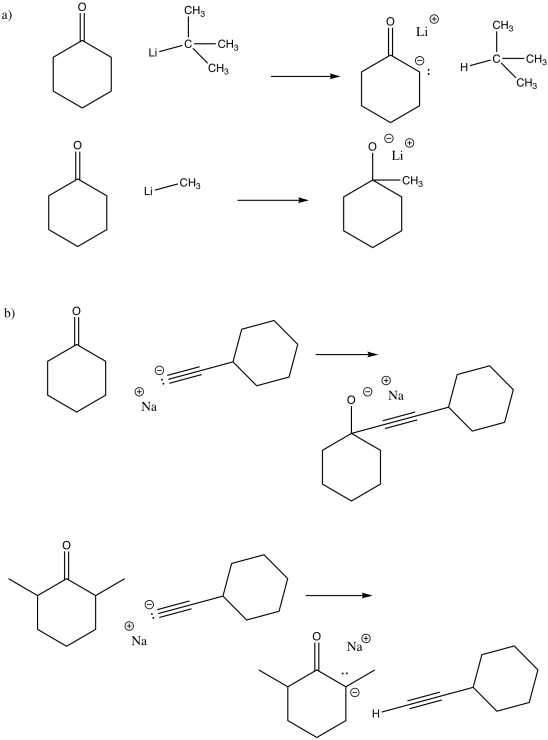
El carbono normalmente no tiene un par solitario, a menos que sea un carbanión. Los carbaniones no suelen ser muy estables. En consecuencia, no son muy comunes, a excepción del cianuro (CN -) y los acetiluros (RCC -, en los que R es un hidrógeno o un grupo alquilo). Sin embargo, cuando el carbono sí tiene un par solitario (y una carga negativa), es un buen nucleófilo. Debido a que el carbono es menos electronegativo que otros elementos con pares solitarios, es capaz de donar su par solitario fácilmente.
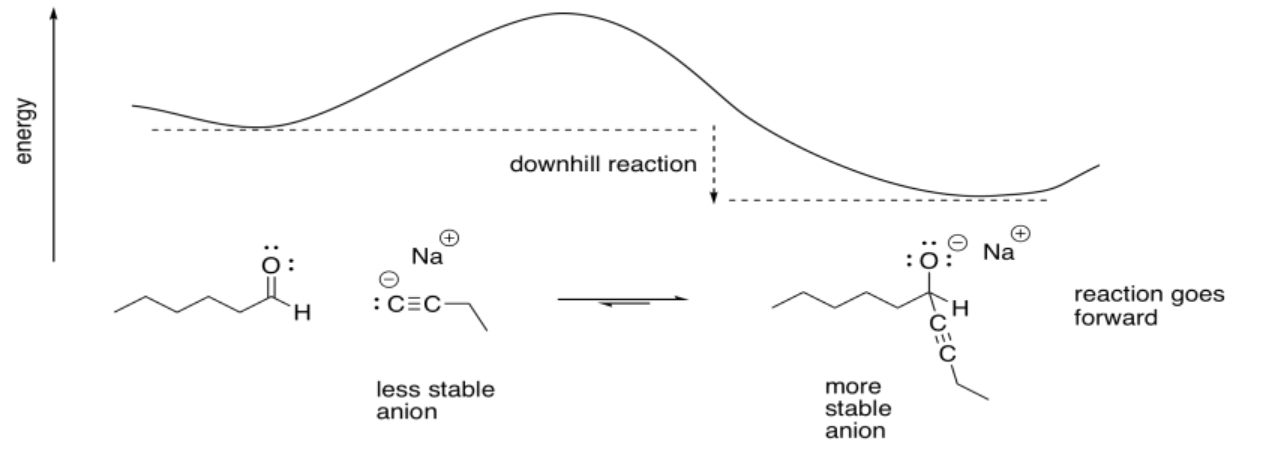
Los nucleófilos de carbono se agregan a los carbonilos porque ese anión de carbono menos estable se comercializa por un anión alcóxido más estable. La reacción es cuesta abajo energéticamente.
Ejercicio\(\PageIndex{1}\)
Los carbaniones como CH 3 - (anión metílico) son muy inestables y altamente reactivos. Explique por qué los siguientes aniones son más estables que un anión metilo.
- Acetilida, CHC -
- cianuro, CN -
- Contestar a
-
En acetiluro, el par solitario está en un carbono lineal o carbono sp. En el anión metilo, el par solitario está en un carbono tetraédrico o carbono sp 3. La descripción “sp” indica que la unión sigma a los vecinos implica un orbital 2s y un orbital 2p sobre carbono; hay una contribución del 50% desde el orbital s.
La descripción “sp 3 “, por otro lado, indica que la unión sigma a los vecinos involucra un orbital 2s y tres orbitales 2p; hay una contribución de 25% desde el orbital s.
El orbital 2s es menor en energía que el orbital 2p. Cuanto mayor sea la contribución orbital s al enlace (o en este caso al par solitario), menor será en energía. Así, un par solitario en un carbono sp es menor en energía que un par solitario en un carbono sp 3.
- Respuesta b
-
En el cianuro, el mismo argumento esbozado en la parte (a) es cierto. Además, el nitrógeno electronegativo cercano estabiliza la carga atrayendo la densidad electrónica hacia sí mismo.
Otros nucleófilos, como los haluros, no proceden. Van cuesta arriba, de un ion haluro más estable a un ion alcóxido menos estable.
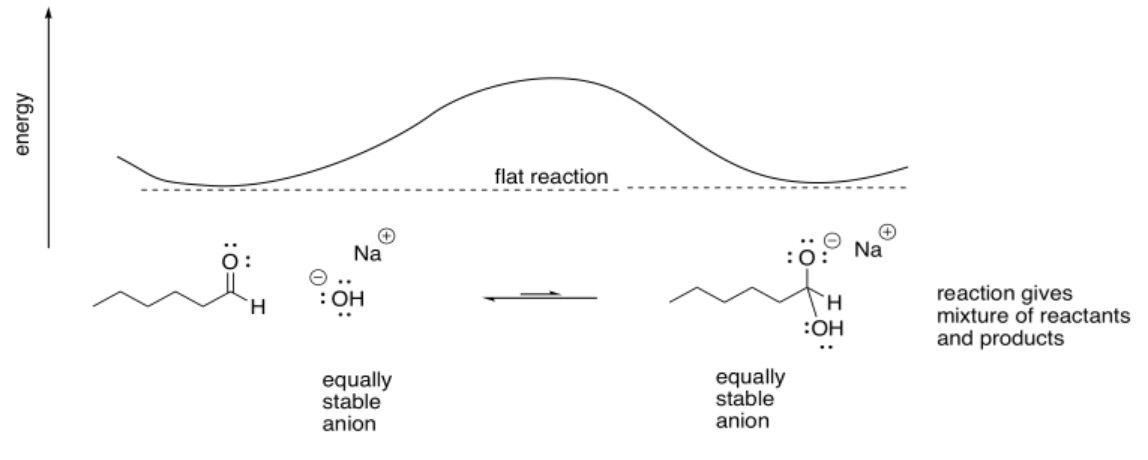
Si el átomo nucleofílico fuera un anión de oxígeno, podría haber un equilibrio. La reacción no sería ni cuesta arriba ni cuesta abajo. Se traduciría en una mezcla de los reactivos originales y los nuevos productos.
Ejercicio\(\PageIndex{2}\)
La nucleofilia es el grado de atracción de un nucleófilo a una carga positiva (o carga positiva parcial). Se relaciona con la basicidad. Elija el ítem más nucleofílico de cada uno de los siguientes pares, y explique su respuesta.
- CH 3 OK o CH 3 OH
- CH 3 OH o CH 3 NH 2
- NaCN o NACH
- C-c 6 H 11 ONa o C-c 6 H 5 ONa (c- en este caso significa “ciclo”)
- Contestar a
-
CH 3 OK, debido al enlace iónico O-K. Se trata de un nucleófilo aniónico. Es más reactivo y nucleófilo que el nucleófilo neutro correspondiente.
- Respuesta b
-
CH 3 NH 2, porque el nitrógeno es menos electronegativo que el oxígeno. Su pareja solitaria se sostiene con menos fuerza y se dona más fácilmente al electrófilo.
- Respuesta c
-
NACH, debido a que el carbono vecino en este caso no tiene el efecto inductivo de extracción de electrones que el nitrógeno tiene en el caso del NaCN. En ese caso, el par solitario se estabiliza y se hace menos reactivo.
- Respuesta d
-
C-c 6 H 11 ONa, debido a que la carga negativa se localiza en un átomo. En c-C 6 H 5 ONa, la carga negativa se deslocaliza en cuatro posiciones diferentes en la molécula. La deslocalización de la carga estabiliza el anión y lo hace menos reactivo.
Ejercicio\(\PageIndex{3}\)
Los compuestos carbonílicos como los aldehídos y las cetonas contienen un hidrógeno muy ligeramente ácido junto al carbonilo. Algunos nucleófilos son lo suficientemente básicos como para eliminar ese protón en lugar de donar al carbonilo. Mostrar por qué el anión resultante es estable, usando ciclopentanona como ejemplo.
- Contestar
-
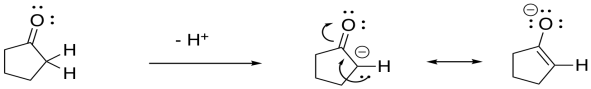
El anión resultante se estabiliza por resonancia.
Ejercicio\(\PageIndex{4}\)
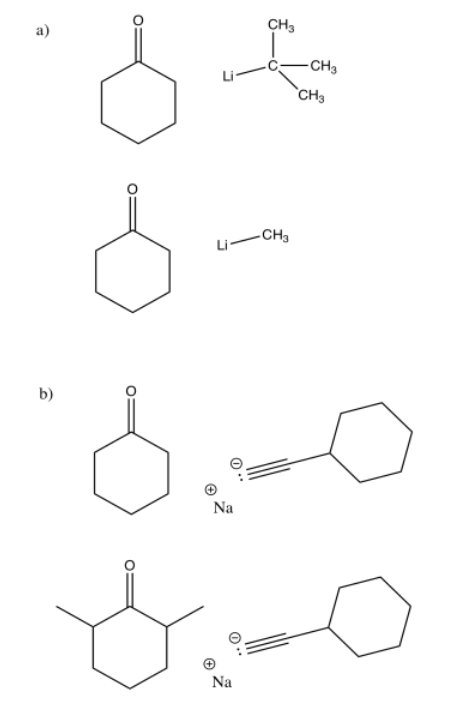
La desprotonación accidental (eliminación de protones) alfa a un carbonilo (un carbono lejos del carbonilo) puede ocurrir cuando se agrega un nucleófilo a una cetona. Una razón por la que el protón podría tomarse en su lugar es si el carbonilo está demasiado abarrotado para que el nucleófilo lo alcance.
En los siguientes casos, explique qué nucleófilo tiene más probabilidades de agregar al carbonilo en la ciclohexanona y cuál es más probable que lo desprotonen.
- Contestar
-
El caso con más hacinamiento estérico es más probable que resulte en desprotonación.