3.27: Protonación del Anión Alcóxido
- Page ID
- 79467
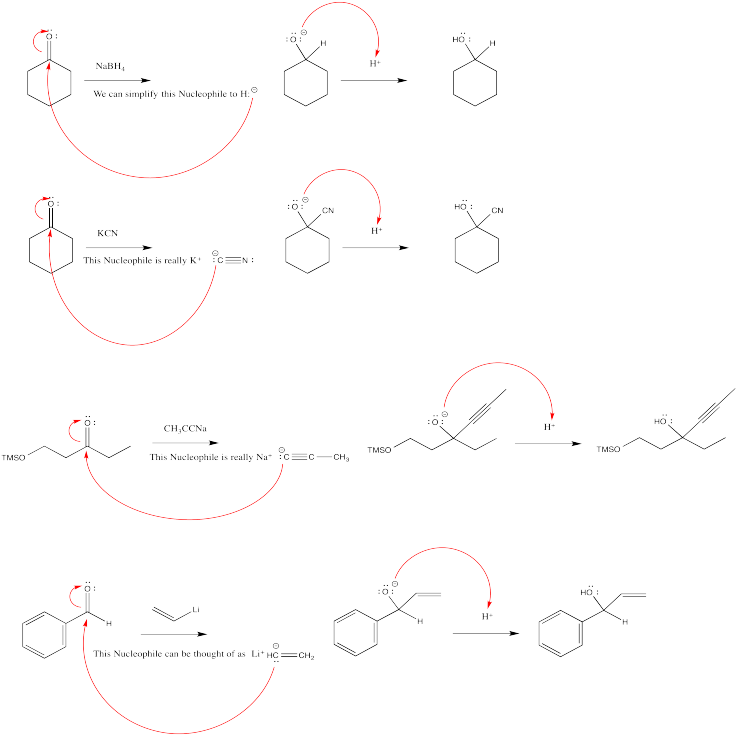
Después de la adición de un nucleófilo aniónico, las mezclas de reacción generalmente se tratan con agua o ácido acuoso diluido. El ácido proporciona un protón que puede ser captado por el ion alcóxido formado en la adición nucleofílica. Como resultado se forma un alcohol. En general, las reacciones de adición de carbonilo generalmente implican la adición de un nucleófilo al carbono carbonilo y la adición de un protón al oxígeno carbonilo.
El orden de estos pasos puede ser muy importante. Sobre el papel, un carbonilo podría convertirse en un alcohol agregando un protón al oxígeno del carbonilo, y luego agregando un nucleófilo al carbono carbonilo. Sin embargo, las cosas podrían no funcionar de esa manera en la realidad. El problema potencial radica en el hecho de que los nucleófilos aniónicos pueden ser bastante básicos. Si primero se agregan protones, es probable que el nucleófilo aniónico recoja un protón en lugar de donar al carbonilo. Una vez que el nucleófilo ha captado un protón, ya no es aniónico, y se siente menos atraído por el carbonilo parcialmente positivo. Además, pudo haber donado su único par solitario al protón, dejándolo completamente incapaz de donar al carbonilo.
¿Cuál es la fuente de protones? En la mayoría de los casos, se usa una solución acuosa diluida de un ácido fuerte. Es decir, un poco de ácido fuerte se disuelve en agua para proporcionar muchos protones para formar el alcohol. Los ácidos fuertes más comunes son el ácido clorhídrico, HCl y ácido sulfúrico, H 2 SO 4.

En realidad, solo el agua misma sería suficiente para donar protones. El agua tiene un enlace O-H polar y por lo tanto puede transferir un ion de hidrógeno positivo a un anión. Sin embargo, eso daría como resultado el intercambio de un anión de oxígeno por otro. Energéticamente, no habría mucha diferencia entre tener la carga negativa en el producto de reacción, el alcóxido o en el ion hidróxido del agua. Es por eso que generalmente se agrega un ácido fuerte.
En términos de le Chatelier, si agregaste suficiente agua, deberías poder conducir ese equilibrio hacia la derecha. No obstante, siempre quedaría un poco de alcóxido sin protonar al final.
Ejercicio\(\PageIndex{1}\)
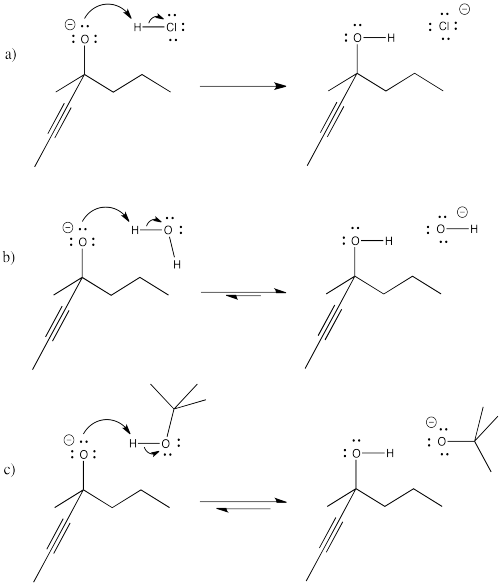
Problema CO8.1.
Proporcionar flechas curvas y predecir la dirección del equilibrio en los siguientes casos.
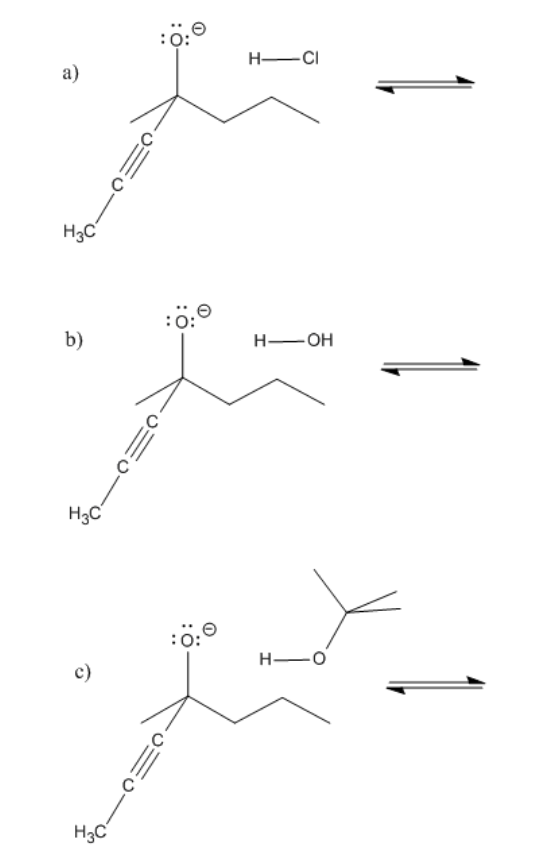
- Contestar
-
Ejercicio\(\PageIndex{2}\)
Problema CO8.2.
Supongamos que la adición nucleofílica se realizó en metanol (10 mL) como disolvente, utilizando 25 microlitros de ciclopentanona y una cantidad equimolar como la de cianuro de sodio (eso significa el mismo número de moles de cianuro de sodio que la ciclopentanona).
- Mostrar el mecanismo para la reacción, usando flechas curvas en cada paso.
- Comentar cómo el uso del metanol como disolvente (en lugar de simplemente agregar una cantidad equimolar de metanol) influiría en la dirección del equilibrio para la etapa final de protonación.
- Contestar
-

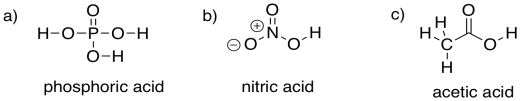
Ejercicio\(\PageIndex{3}\)
Proporcionar estructuras para los siguientes ácidos. Son ácidos moderadamente fuertes, pero no tan comúnmente utilizados en este contexto como el ácido clorhídrico y sulfúrico. Tenga en cuenta que, al igual que el ácido sulfúrico, todos contienen grupos OH polares.
a) ácido fosfórico, H 3 PO 4 b) ácido nítrico, HNO 3 c) ácido acético, CH 3 CO 2 H
- Contestar
-
En ocasiones, se utilizan ácidos débiles para protonar el alcóxido intermedio. Estos ácidos son más ácidos que el agua, por lo que el equilibrio en la reacción de protonación se encuentra más hacia el lado del alcohol. Sin embargo, debido a que solo son ácidos débiles, son más seguros y fáciles de trabajar que los ácidos fuertes. Los ejemplos de comonas incluyen cloruro de amonio y bicarbonato de sodio.
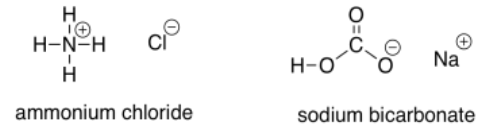
Ejercicio\(\PageIndex{4}\)
¿Qué factor hace que cada uno de estos compuestos sea ligeramente ácido?
- Contestar
-
El cloruro de amonio tiene un enlace N-H, normalmente menos polar que el enlace O-H del agua. Sin embargo, la carga positiva hace que este compuesto renuncie más fácilmente a un protón, ya que da como resultado una molécula de amoníaco neutra (sin carga).
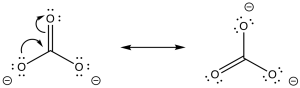
El carbonato de sodio tiene un enlace O-H polar, al igual que el agua. Sin embargo, el anión que resulta de la pérdida de un protón está estabilizado por resonancia. Eso hace que este compuesto sea más ácido que el agua.
Ejercicio\(\PageIndex{5}\)
Problema CO8.5.
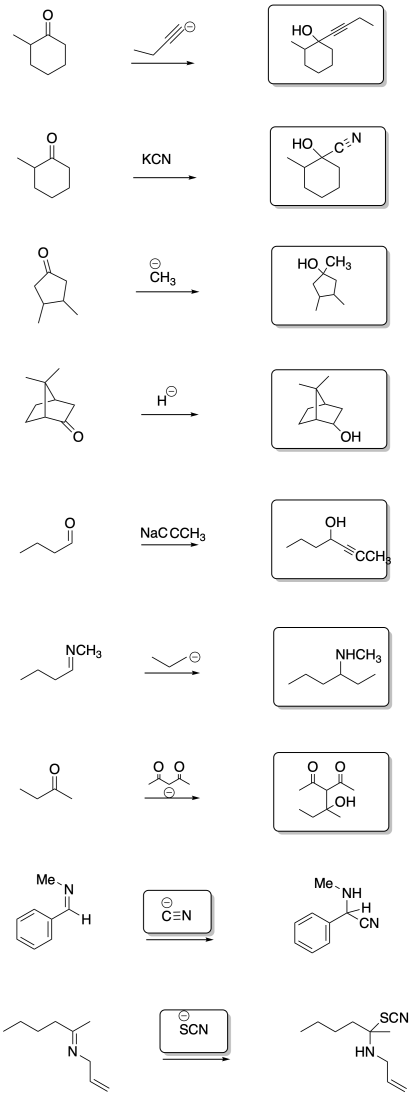
Rellenar el producto o reactivo para cada una de las siguientes transformaciones. Recuerde que siempre se supone un tratamiento ácido.
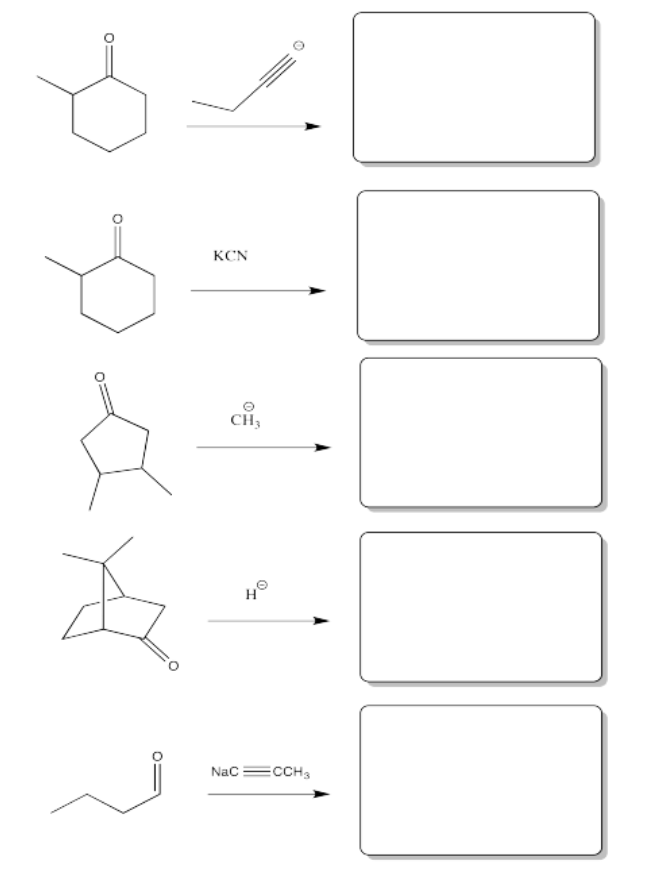
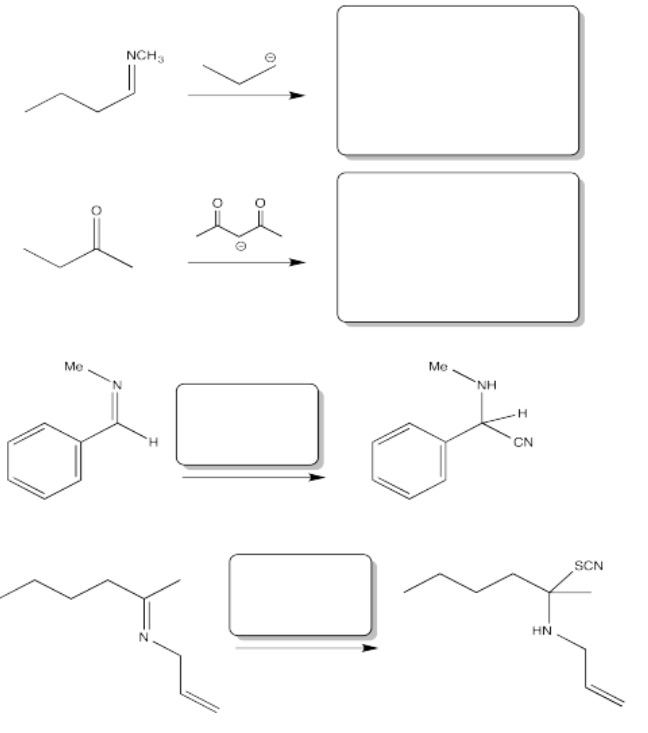
- Contestar
-
Ejercicio\(\PageIndex{6}\)
Dibuja un mecanismo con flechas curvas para cada una de las transformaciones enumeradas a continuación. Mostrar todos los intermedios. Asumir un tratamiento ácido.
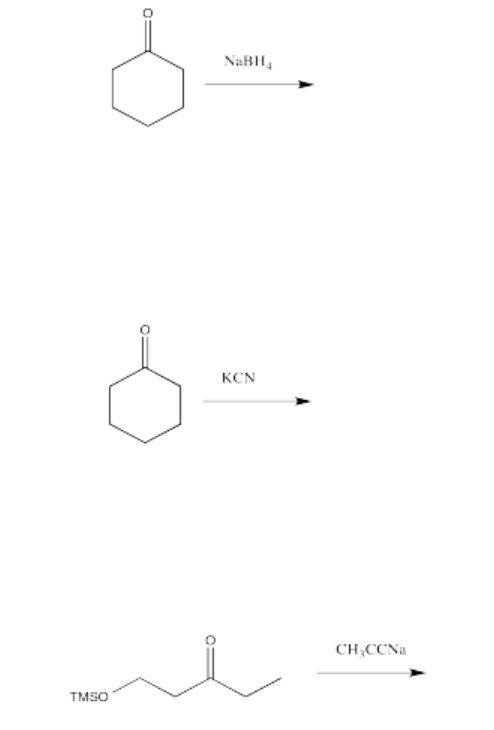
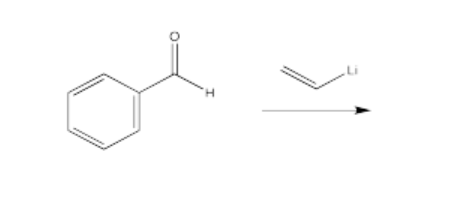
- Contestar
-