6.3: Estrategias en Catálisis Enzimática
- Page ID
- 79459
Una vez que un sustrato se ha unido, el trabajo de la enzima es transformar rápidamente el sustrato en producto. La enzima lo hace transportando el sustrato sobre una vía catalítica. En una vía catalítica, la reacción toma un curso diferente al que tendría por sí sola. A veces la vía catalítica es más larga, lo que implica pasos adicionales, pero debido a que el terreno energético es más fácil de atravesar que en el proceso no catalizado, la reacción catalítica en realidad lleva mucho menos tiempo.
Las enzimas tienen una gama de estructuras y propiedades de reacción, por lo que hay un gran número de reacciones diferentes que pueden catalizar. Sin embargo, existen algunas estrategias comunes que se muestran en las reacciones catalíticas que son útiles de conocer.
Aproximación
Cuando hacemos una aproximación, nos estamos acercando a la respuesta. Si alguien nos pregunta qué hora es, y son las 3:02pm, probablemente les decimos que son como las tres en punto. Eso es lo suficientemente cerca.
En la catálisis enzimática, la aproximación significa acercar las cosas entre sí. Si tenemos un sustrato que va a reaccionar con algo, la enzima puede unirse al sustrato de tal manera que el sustrato esté muy cerca del reactivo. A veces, pero no siempre, eso podría significar unir dos sustratos, para que puedan reaccionar más fácilmente entre sí. Si quieres conocer a tu amigo, es una idea mucho mejor decirlo, reunámonos en el Café Santropol a las 7:00, en lugar de pasear por las calles de Montreal, junto con otros cuatro millones de personas, esperando chocar con tu amigo. El reactivo y el sustrato son mucho más propensos a encontrarse en los confines protegidos de la enzima que flotando en el desierto de la célula.
- En aproximación, dos sustratos se mantienen juntos dentro de la enzima
- Esta proximidad los hace reaccionar juntos más fácilmente
A veces, esta idea puede ser un poco más sutil. Imagínese que el reactivo es la propia enzima, de manera que con solo unir el sustrato único, la reacción ya es mucho más probable que ocurra. El sustrato puede mantenerse de tal manera que ya esté muy cerca de las cadenas laterales de aminoácidos que trabajarán en él y lo transformarán en una nueva molécula.
- En aproximación, el sustrato se mantiene en posición de manera que la reacción posterior es mucho más probable
La aproximación es realmente un factor de entropía. Al unir el sustrato, podemos limitar sus grados de libertad, restringiendo su ubicación o incluso su orientación para que no haya forma de que el reactivo pueda perder su objetivo pretendido.
Por supuesto, los sustratos aún tienen que encontrar el sitio activo de la enzima. En ocasiones, esa tarea es ayudada por superficies pegajosas en la enzima; puede haber grupos en la superficie de la enzima que pueden interactuar con sustratos, de manera que es menos probable que los sustratos se alejen después de una colisión aleatoria con la enzima. Con su movimiento así restringido, es más probable que el sustrato se mueva hacia el sitio activo que desviarse a través de la célula una vez más.
Aunque estamos discutiendo enzimas en la célula, otros tipos de catálisis también hacen uso de la aproximación. Por ejemplo, la catálisis de metales de transición a menudo hace uso de trozos sólidos de metal para catalizar las reacciones de los vapores gaseosos. La superficie del metal da a las moléculas en fase gaseosa un lugar para unirse, dándoles un lugar para reunirse, en lugar de deambular en tres dimensiones en la fase gaseosa. Una vez que están juntos en un lugar, es más probable que reaccionen entre sí o con especies adicionales en la superficie del metal.
Catálisis ácido-base
La catálisis ácido-base es un fenómeno muy común. Tantas reacciones implican la adición o eliminación de protones, especialmente las reacciones de carbonilo que son tan prevalentes en las vías bioquímicas, que los donantes y aceptores de protones se convierten en actores clave. Las cadenas laterales ácidas y básicas de los aminoácidos en la proteína llenan naturalmente estos roles.
¿Qué aminoácidos se piensa que tienen cadenas laterales “ácidas”?
- Contestar
-
Ácido aspártico (abreviaturas Asp o D) y ácido glutámico (abreviaturas Glu o E).
¿Qué aminoácidos se piensa que tienen cadenas laterales “básicas”?
- Contestar
-
Histidina (abreviaturas His o H), lisina (abreviaturas Lys o K) y arginina (abreviaturas Arg o R).
Dibuja las cadenas laterales de aminoácidos ácidos tanto en sus formas básicas ácidas como conjugadas.
- Contestar
-

Dibuja las cadenas laterales de aminoácidos básicos tanto en sus formas ácidas básicas como conjugadas.
- Contestar
-

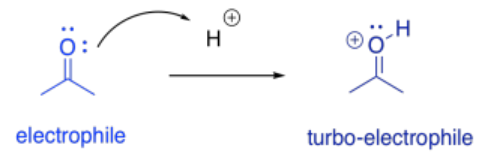
La catálisis ácido-base puede proporcionar ventajas mecanicistas al mejorar rápidamente la electrofilicidad de una molécula. Cualquier compuesto carbonilo es electrófilo, pero si se protonó, la carga positiva general hace que el carbonilo sea aún más electrófilo.
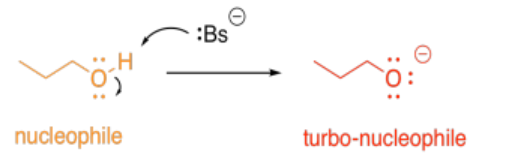
Alternativamente, la catálisis ácido-base podría aumentar la nucleofilia de una molécula. Cualquier alcohol es nucleofílico, porque tiene pares solitarios. Sin embargo, si se elimina su protón, se vuelve aún más nucleófilo, debido a la carga negativa general.
Entonces, en el caso más sencillo, agregar un protón podría acelerar una reacción que involucra a un electrófilo. La eliminación de un protón podría acelerar una reacción que involucra a un nucleófilo.
- Catálisis ácido/base implica transporte rápido de protones
- Las cadenas laterales ácidas pueden activar electrófilos
- Las cadenas laterales básicas pueden activar nucleófilos
Hay otras variaciones sobre este enfoque. Por ejemplo, considere un tautomerismo ceto-enol. Pensamos en las cetonas clásicamente como electrófilos, pero su isómero enol es fácilmente accesible en general, y la forma enol es un excelente nucleófilo. Como parte de una serie de reacciones, la rápida conversión de una cetona en un enol podría ser un paso clave.

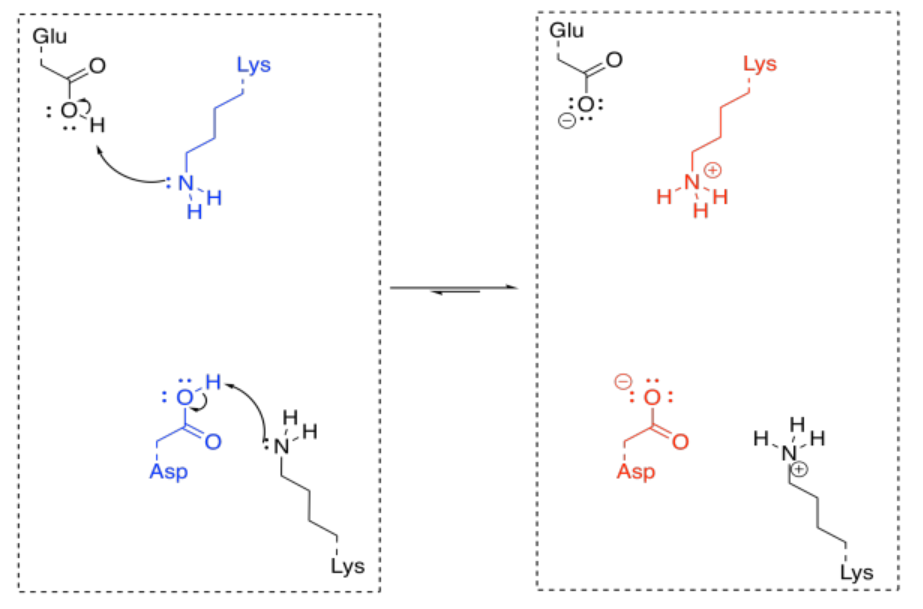
Eso es realmente un par de pasos diferentes; hay que agregar un protón al oxígeno carbonilo, y luego hay que quitarle un protón de la posición alfa. Podrías hacerlo al revés, pero seguirían siendo dos pasos. Afortunadamente, las enzimas tienen muchos sitios ácidos y básicos, por lo que puede haber fuentes y sumideros de protones que están fácilmente disponibles para una molécula unida en una enzima. Además, la molécula puede unirse de tal manera que estas etapas de transferencia de protones sean esencialmente simultáneas.
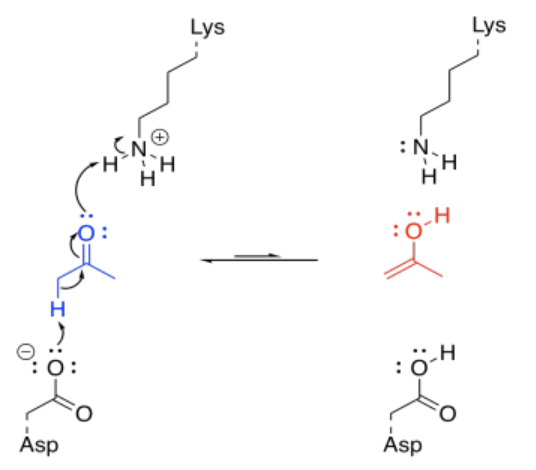
En circunstancias normales, esto parece tres moléculas diferentes que reaccionan juntas; eso es básicamente imposible en circunstancias normales. Pero si la lisina y el aspartato forman parte de la misma enzima, eso reduce el problema a una interacción entre dos moléculas; eso sucede todo el tiempo. Si la cetona ya está unida a la enzima, la dificultad se reduce aún más.
Para que la reacción sea catalítica, la enzima tiene que ser regenerada. Nuevamente, eso no es un problema para las enzimas, debido a la cantidad de sitios ácidos y básicos disponibles. Un sitio clave al que le falta un protón crucial puede recoger uno de otra cadena lateral de aminoácidos que se encuentra cerca. Los estados de protonación se reorganizan con bastante rapidez, y pronto la enzima está lista para volver a funcionar.
Catálisis ácido-base: Catálisis de iones metálicos
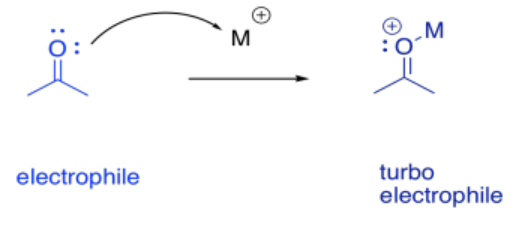
La catálisis de iones metálicos a menudo se puede considerar como un caso especial de catálisis ácido-base. Con iones metálicos, obtenemos catálisis ácida de Lewis. La catálisis ácida de Lewis puede acelerar las reacciones de varias maneras, en estrecha analogía con la catálisis ácido/base general.
A veces ayuda pensar en un metal como un gran protón grande. Eso es una simplificación en exceso, como veremos en un momento. Sin embargo, puede ser útil tener en cuenta la analogía. Cuando un compuesto se une a un ion metálico, el efecto puede ser similar al de unirse a un protón. El compuesto acaba de donar un par de electrones en otra parte (al ion metálico o al protón), y así el compuesto de repente parece deficiente de electrones. Tiene electrofilicidad potenciada.
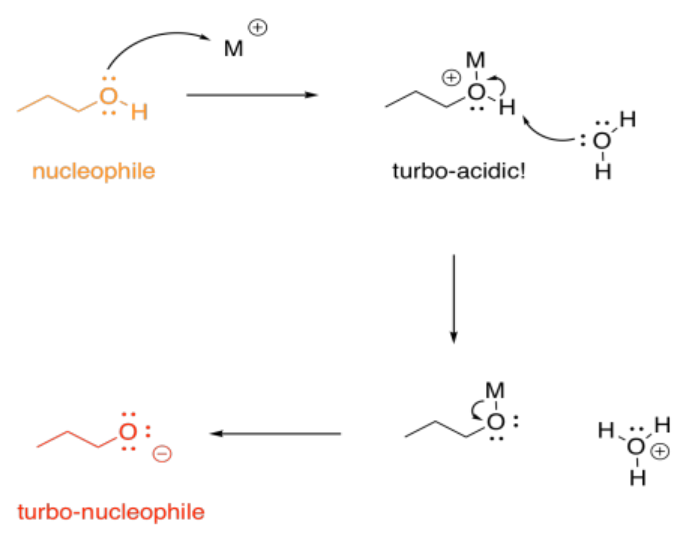
Por otro lado, no solemos pensar en la protonación como causante de una mayor basicidad; eso sería completamente al revés. Con los metales, sin embargo, eso puede suceder, indirectamente. Si un alcohol, por ejemplo, dona un par solitario a un metal, el oxígeno se carga positivamente. Se vuelve mucho más ácido. De pronto, el alcohol puede ser desprotonado por una base muy, muy débil, como el agua. Eso lleva a la formación de un ion alcóxido, que es mucho más nucleofílico que el alcohol original. El agua realmente nunca tomaría un protón de un alcohol, pero puede hacerlo una vez que el oxígeno tiene una carga positiva.
Los iones metálicos pueden desempeñar una serie de otros papeles en la catálisis, pero eso es suficiente para tener una idea de algunas de las formas en que podrían ser útiles. Para obtener más información, tendríamos que explorar más reactividad de los metales de transición, incluida la capacidad de los metales para donar y aceptar electrones individuales.
Transferencia de Grupo
La transferencia de grupo, también llamada catálisis covalente, tiene algo en común con la aproximación. Limita los grados de libertad involucrados en un paso clave del camino hacia el producto. En lugar de simplemente unir dos sustratos cerca uno del otro en el sitio activo, o mantener un sustrato en una orientación específica, la transferencia de grupo implica una reacción entre el sustrato y la enzima de manera que el sustrato se une a la enzima. Se une a través de un enlace covalente.
En cierto sentido, al igual que la aproximación, este mecanismo limita el problema de que dos sustratos choquen entre sí —una perspectiva poco probable en el mar roliing de la célula— a dos cosas que se unen dentro del espacio limitado del sitio activo. Por supuesto, cada vez que una molécula deambula hacia un sitio activo, existe la posibilidad de que pueda volver a deambular; pero eso no es cierto si la abres. Eso es lo que hace la transferencia grupal. Asegura un sustrato a la enzima, de manera que un segundo sustrato es más probable que reaccione con él.
Eso no es todo. A veces, cuando el sustrato, o un grupo que forma la parte crucial del sustrato, se transfiere a una cadena lateral en la enzima, se modifica de tal manera que se vuelve más reactivo. Por ejemplo, un aldehído puede ser electrófilo para empezar. Sin embargo, si se une a un residuo de lisina, puede transformarse en una imina. Ahora bien, una imina puede parecer menos electrófila que un aldehído, porque el nitrógeno es menos electronegativo que el oxígeno. Sin embargo esa misma característica también hace que el nitrógeno sea mucho más básico que el oxígeno. Como resultado, es muy probable que las iminas descansen en estado protonado; es mucho menos probable que los aldehídos sean protonados. Ese ion iminio protonado, por supuesto, es mucho más electrófilo que un aldehído, porque el iminio tiene una carga positiva completa.
La transferencia de grupo puede incluso dar como resultado una inversión completa de la reactividad en el sustrato. De nuevo, en el caso en el que un aldehído se une a un residuo de lisina, el aldehído puede transformarse en una enamina. La diferencia entre formar una enamina y una imina es solo la diferencia en cuál de los protones se elimina. En una enzima, esa decisión se resuelve fácilmente por el posicionamiento de la cadena lateral del aminoácido que elimina el protón. En una enzima, esta cadena lateral elimina el protón más cercano, conduciendo a una imina. En otra enzima, otra cadena lateral, situada en un lugar diferente, elimina el protón más cercano, conduciendo a una enamina.
Por supuesto, la consecuencia de formar una enamina en lugar de una imina es muy parecida a tener un enolato o enol en lugar de un aldehído. El primero es nucleofílico, aunque el segundo es electrófilo. Entonces, la transferencia grupal puede incluso voltear algo de un electrófilo a un nucleófilo.
Un ejemplo muy diferente que también es bastante común involucra un conjunto de cadenas laterales de aminoácidos llamadas “la tríada catalítica”. Estos tres grupos —aspartato, histidina y serina— se observan frecuentemente en la catálisis de transferencia de grupos. Con la tríada catalítica, es la serina la que actúa como nucleófilo, más que como lisina. Como resultado, es la serina la que se une al sustrato. El papel del aspartato y la histidina es actuar como un relé de protones, ayudando a activar la serina para que se convierta en un nucleófilo más efectivo.
Estabilización del Estado de Transición
Pensamos que las enzimas son perfectamente adecuadas para unirse a un sustrato en particular, pero tal vez no sea el caso en absoluto. Si lo piensas bien, una enzima que coincida perfectamente con su sustrato recogería su sustrato, lo encajaría en su lugar y... eso sería todo. Nunca pasaría nada más. El sustrato se sentaría ahí para siempre. ¿Por qué meterse con la perfección?
En cambio, se piensa que, al menos en algunos casos, la enzima es ideal para unir algo un poco más adelante en el camino. La idea es que el sustrato cambie de forma a medida que pasa por la reacción, y si la enzima realmente se ajusta mejor a la forma de otra cosa por venir, ejercerá presión sobre el sustrato para seguir adelante y reaccionar. Una vez que el sustrato llegue a la forma correcta, será recompensado con una encuadernación perfecta.
En el caso extremo, podríamos pensar en que la enzima es una combinación perfecta para el producto. De esa manera, la enzima podría inducir la reacción, y la fuerte interacción de unión entre la enzima y el producto arrastraría la reacción a través de su equilibrio hasta el lado del producto.
Bueno, si lo piensas bien, tampoco funcionaría muy bien. Una vez que se forme el producto, se uniría perfectamente con la enzima, que nunca la dejaría ir. ¿De qué sirve si el producto está hecho pero nunca se libera en la celda? El objetivo de la catálisis enzimática es hacer rápidamente las cosas que la célula necesita desesperadamente; sin estas cosas, la célula morirá.
Pero hay un tipo de estructura que podría unir perfectamente a la enzima, y no tendríamos que preocuparnos de que se atascara. Es un estado de transición. Un estado de transición es una estructura inherentemente antinatural; la molécula no puede permanecer así por mucho tiempo. Simplemente está de paso en su camino de una estructura a otra, y el estado de transición es la fase incómoda y desgarrada en el medio, esa cosa horrible que vislumbramos en la oscuridad cuando piensa que no estamos mirando.
Entonces, si estabilizamos esa cosa, entonces el sustrato se empuja hacia adelante, un poco más, y justo cuando llega al punto perfecto, encuentra que ha ido demasiado lejos. Debe colapsar. Es como Wile E. Coyote logrando sublimemente su objetivo justo cuando pasa por encima del borde del acantilado.
Estabilización del estado de transición: distorsión
Si la estabilización del estado de transición es la zanahoria, entonces la distorsión es el palo. La estabilización del estado de transición coacciona el sustrato más adelante; la distorsión empuja y prods hasta que el sustrato ya no lo puede tomar.
En distorsión, el sustrato se encuentra en un sitio de unión en el que su forma no es del todo correcta. Su geometría está sutilmente apretada. El sustrato en sí está desestabilizado, mientras que la formación del producto, o el estado de transición que conduce al producto, en realidad alivia esa tensión.
Un buen ejemplo es un átomo que se supone que es plano trigonal, pero se encuentra sentado en un lugar donde no puede quedar plano del todo. En cambio, encuentra interacciones intermoleculares que lo están empujando a otra forma; tal vez tetraédrica sería un mejor ajuste.
Si un intermedio tetraédrico se encuentra por delante, entonces para cuando lleguemos al estado de transición, la geometría de ese átomo en realidad puede parecerse más a un tetraedro que a un plano trigonal. Como resultado, esas fuerzas intermoleculares están distorsionando la estructura por lo demás estable del sustrato y doblándose hacia el estado de transición.

