7.4: Regulación de las vías metabólicas A - ¿Cómo se regula la actividad enzimática?
- Page ID
- 79226
Han evolucionado mecanismos exquisitos que controlan el flujo de metabolitos a través de vías metabólicas para asegurar que la salida de las vías satisfaga la demanda biológica y que la energía en forma de ATP no se desperdicie al tener vías opuestas que se ejecutan concomitantemente en la misma célula.
Las enzimas pueden regularse cambiando la actividad de una enzima preexistente o cambiando la cantidad de una enzima.
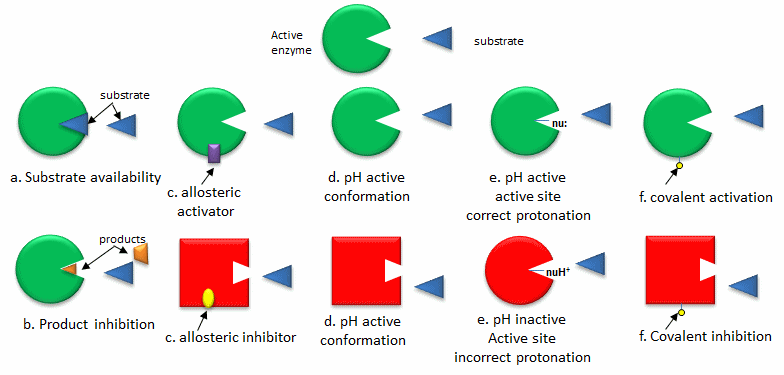
A. Cambio de la actividad de una enzima preexistente: La forma más rápida de modular la actividad de una enzima es alterar la actividad de una enzima que ya existe en la célula. La siguiente lista, ilustrada en la siguiente figura, da formas comunes de regular la actividad enzimática
- Disponibilidad de sustrato: Los sustratos (reactivos) se unen a enzimas con una afinidad característica (caracterizada por una constante de disociación) y un parámetro cinético llamado Km (unidades de molaridad). Si la concentración real de un sustrato en una célula es mucho menor que la Km, la actividad de la enzima es muy baja. Si la concentración de sustrato es mucho mayor que Km, el sitio activo de la enzima se satura con sustrato y la enzima es máxima activa.
- Inhibición del producto: Un producto de una reacción catalizada por enzimas a menudo se asemeja a un reactivo de partida, por lo que debe quedar claro que el producto también debe unirse al sitio de actividad, aunque probablemente con menor afinidad. Bajo condiciones en las que el producto de una reacción esté presente en alta concentración, sería energéticamente ventajoso para la célula si no se sintetizara más producto. Por tanto, la inhibición del producto se observa comúnmente. De igual manera, sería energéticamente ventajoso para una célula si el producto final de una vía completa pudiera igualmente unirse a la enzima inicial en las vías e inhibirla, permitiendo que se inhiba toda la vía. Este tipo de inhibición de retroalimentación es comúnmente oberved
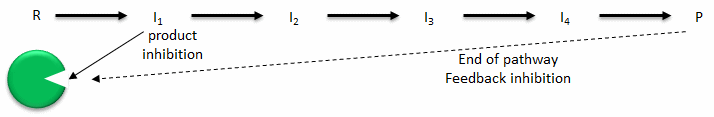
- Regulación alostérica: Como muchas vías están interconectadas, sería óptimo que las moléculas de una vía afectaran la actividad de las enzimas en otra vía interconectada, incluso si las moléculas en la primera ruta son estructuralmente diferentes a los reactivos o productos en una segunda vía. Las moléculas que se unen a sitios en enzimas diana distintas del sitio activo (sitios alostéricos) pueden regular la actividad de la enzima diana. Estas moléculas pueden ser estructuralmente diferentes a las que se unen en el sitio activo. Lo hacen mis cambios conformacionales que pueden activar o inhibir la actividad de la enzima diana.
- pH y conformación enzimática: Los cambios en el pH que pueden acompañar el proceso metabólico como la respiración (glucólisis aeróbica por ejemplo) pueden alterar la conformación de una enzima y, por lo tanto, la actividad enzimática. Los cambios iniciales son covalentes (cambio en el estado de protonación de la proteína) lo que puede conducir a una alteración en el delicado equilibrio de fuerzas que afectan la estructura de la proteína.
- pH y estado de protonación del sitio activo: Los cambios en el pH pueden afectar el estado de protonación de las cadenas laterales de aminoácidos clave en el sitio activo de las proteínas sin afectar la conformación local o global de la proteína. La catálisis puede verse afectada si el mecanismo de catálisis involucra un nucleófilo de sitio activo (por ejemplo), que debe ser desprotonado para su actividad.
- Modificación covalente: Muchas, si no la mayoría de las proteínas, se someten a modificaciones postraduccionales que pueden afectar la actividad enzimática a través de cambios de forma locales o globales, promoviendo o inhibiendo la interacción de unión de sustratos y reguladores alostéricos, e incluso cambiando la ubicación de la proteína dentro la celda. Las proteínas pueden estar fosforiladas, acetiladas, metiladas, sulfatadas, glicosiladas, amidadas, hidroxiladas, preniladas, miristoladas, a menudo de manera reversible. Algunas de estas modificaciones son reversibles. La regulación por fosforilación a través de la acción de quinasas, y la desfosforilación por fosfatos es extremadamente común. El control del estado de fosforilación está mediado a través del proceso de transducción de señales que comienza en la membrana celular, lo que lleva a la activación o inhibición de proteínas quinasas y fosfatasas dentro de la célula.
La quinasa regulada extracelular 2 (ERK2), también conocida como mitógeno activa la proteína quinasa 2 (MAPK2) es una proteína que juega un papel vital en la señalización celular a través de la membrana celular. La fosforilación de ERK2 en Treonina 183 (Thr153) y Tirosina 185 (Tyr185) conduce a un cambio estructural en la proteína y la regulación de su actividad.
Jmol: Erk2 - Comparación estructural de enzimas fosforiladas y desfosforiladas
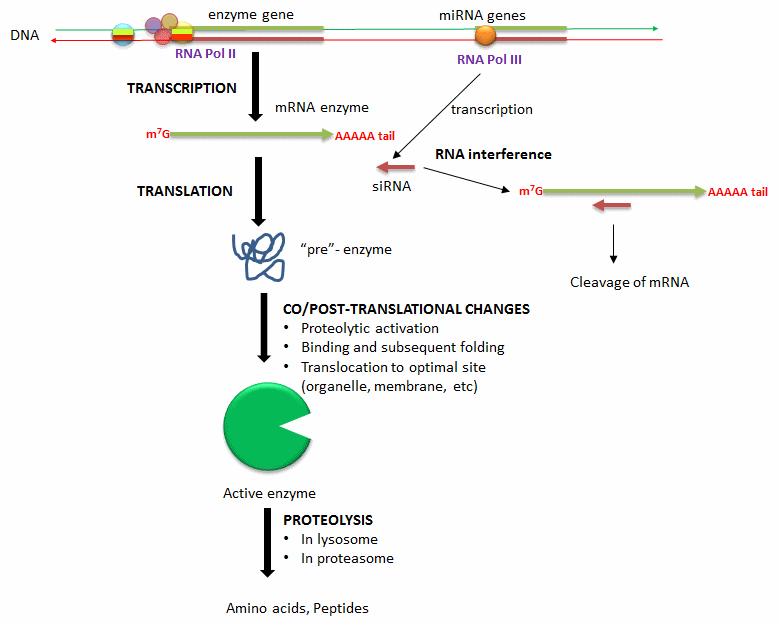
B. Cambiar la cantidad de una enzima: Otro método menos inmediato pero de mayor duración para modular la actividad de una enzima es alterar la actividad de una enzima que ya existe en la célula. La siguiente lista, ilustrada en la siguiente figura, muestra la manera en que se regula la concentración de enzimas.
- Alternancia en la transcripción del gen de la enzima: La señal extracelular (hormonas, neurotransmisores, etc) puede conducir a respuestas de transducciones de señal y última activación o inhibición de la transcripción del gen para una enzima proteica. Estos cambios son el resultado del reclutamiento de factores de transcripción (proteínas) a secuencias de ADN que regulan la transcripción del gen enzimático.
- Degradación del ARN mensajero para la enzima: Los niveles de ARN mensajero para una proteína determinarán directamente la cantidad de esa proteína sintetizada. Los ARN inhibidores pequeños, derivados de moléculas de microARN transcritas a partir de ADN celular, pueden unirse a secuencias específicas en el ARNm de una enzima diana. El complejo de ARN bicatenario resultante recluta una enzima (Dicer) que escinde el complejo con el efecto de disminuir la traducción de la enzima proteica a partir de su ARNm.
- Cambios co/post traduccionales: Una vez que una enzima proteica se traduce a partir de su ARNm, puede sufrir cambios para afectar los niveles enzimáticos. Algunas proteínas se sintetizan en una forma “pre” que debe ser escindida de una manera dirigida y limitada por las proteasas para activar la enzima proteica. Algunas proteínas no están completamente plegadas y deben unirse a otros factores en la célula para adoptar una forma catalíticamente activa. Finalmente, la proteína completamente activa puede ser completamente proteolizada por el proteasoma, un complejo dentro de las células, o en lisosomas, que son orgánulos dentro de las células que contienen enzimas proteolíticas.
A continuación consideraremos qué enzimas en vías hacen la mejor diana para la regulación.

