7.5: Regulación de las Vías Metabólicas B - ¿Qué enzimas son óptimas para la regulación?
- Page ID
- 79224
Todas las proteínas son reguladas en última instancia, aunque sólo sea modulando las tasas de su síntesis y degradación. Sin embargo, algunas enzimas posicionadas en puntos clave en las vías metabólicas son candidatos ideales para la regulación, ya que su actividad puede afectar la salida de vías enteras. Estas enzimas suelen tener dos características comunes, catalizan reacciones lejos del equilibrio y catalizan etapas tempranas comprometidas en vías.
A. Regulación de enzimas para reacciones no en equilibrio
Las enzimas óptimas para la regulación son las que se encuentran al inicio de las vías y que realizan reacciones termodinámicamente favorecidas. ¿Por qué es tan importante este último? Estas enzimas controlan el flujo de metabolitos a través de la vía, por lo que para entender su regulación podemos usar la analogía del flujo (o flujo) de agua de un recipiente a otro. Digamos que deseas llenar una piscina a cualquier altura deseada que desees y tienes dos formas de hacerlo (ver figura abajo). Podrías abrir una válvula que controle el flujo desde la torre de agua de tus pueblos hasta la alberca. En esto la reacción (flujo de agua) se ve favorecida energéticamente (termodinámicamente) dada la diferencia de altura de los niveles de agua y la diferencia de energía potencial entre los dos. A pesar de que el flujo (o flujo) se aclara con sabor, se puede regular, de no flujo, al flujo máximo, abriendo y cerrando la válvula (análogo a activar e inhibir una enzima). Tus elecciones en el otro escenario, llenar la piscina desde un lago, no son tan buenas. Sería difícil llenar el agua hasta el nivel deseado (especialmente si se trataba de una piscina sobre el suelo). Sería difícil regular el flujo.
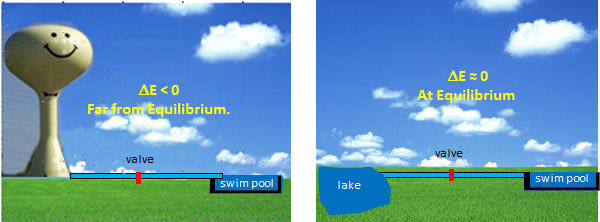
Por analogía, los mejores candidatos a la regulación son aquellas enzimas cuyas reacciones se ven favorecidas termodinámicamente (no en equilibrio) pero que pueden ser controladas por los mecanismos discutidos en el apartado anterior.
¿Qué reacciones comúnmente no están en equilibrio (es decir,\(\Delta G^o<0\) y generalmente también\(\Delta G^o<0\) si la relación de productos a reactivos no es demasiado alta)? La respuesta son aquellos que tienen reactivos que son termodinámicamente inestables en comparación con sus productos de reacción. Hay varios tipos de reacciones que a menudo se ajustan a estos criterios:
Hidrólisis (o reacciones similares) de anhídrido o motivos análogos: La siguiente figura muestra moléculas con motivos similares de “anhídrido” y la\(\Delta G^o\) de hidrólisis de las moléculas. Aquellos con\(\Delta G^o\) valores más negativos pueden transferir su grupo fosfato a ADP para producir ATP, lo cual es necesario para impulsar reacciones biológicas desfavorables. Las reacciones metabólicas que implican hidrólisis (u otro tipo de reacción de transferencia de estos grupos) generalmente proceden con un negativo\(\Delta G^o\) y\(\Delta G\), haciéndolas primeras candidatas para la regulación de la vía. Muchos libros de texto etiquetan a este tipo de moléculas como que tienen enlaces de “alta energía”. Esto es confuso para muchos estudiantes ya que los enlaces entre átomos reducen la energía en comparación con cuando los átomos no están unidos. Se necesita energía para romper el enlace covalente de fosfoanhídrido de “alta” energía. Lo que hace que la hidrólisis de las moléculas de abajo sea tan exergónica es que se libera más energía en la formación de enlaces dentro de los nuevos productos de la que se requería para romper los enlaces en los reactivos. Además, otros efectos como la hidratación preferencial de los productos, menor densidad de carga en los productos y menos resonancias competitivas en los productos contribuyen a la hidrólisis termodinámicamente favorable de los reactivos.
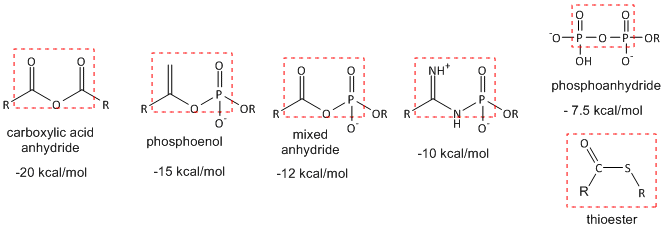
También se incluyen tioésteres (como acetil-SCOA) ya que tienen el mismo negativo\(\Delta G^o\) de hidrólisis que el ATP, a pesar de que carecen de un motivo “anhídrido”. Los tioésteres se desestabilizan en comparación con sus productos de hidrólisis y en comparación con los ésteres elaborados con alcohol ya que el enlace C-S es más débil. ¿Por qué?
Reacciones redox: Todo el mundo sabe que las reacciones redox son favorecidas termodinámicamente si el agente oxidante desplegado es lo suficientemente fuerte. Las reacciones de oxidación de hidrocarburos, azúcares y grasas por dioxígeno son claramente exergónicas (después de todo llamamos a estas reacciones de combustión). ¿Qué pasa con las reacciones redox con oxidantes menos potentes? El NAD+ se usa frecuentemente como agente oxidante biológico. ¿Todas estas reacciones son tan favorecidas como la combustión? Apenas así. Recuerde que en cada reacción redox, un agente oxidante y reductor reacciona para formar otro agente oxidante y reductor. Considera la siguiente reacción:
\[\ce{Pyruvate + NADH -> Lactate + NAD^{+}}.\]
Esta reacción puede ir en cualquier dirección y es reversible. En la forma anterior, se escribe en la dirección favorecida en el metabolismo aeroboico cuando tanto el nivel de Pyr como el NADH son altos. Aunque\(\Delta G^o\) en realidad favorece la oxidación del lactato, dada la alta concentración de Pyr y NADH, la reacción es conducida en sentido contrario y procede como se muestra. Para determinar si una reacción redox es favorecida y probable que ocurra, y posiblemente ser regulada, la\(\Delta G^o\) para una reacción redox debe calcularse a partir de potenciales de reducción estándar, usando la fórmula
\[\Delta G^o = -nFE^o.\]
B. Regulación de enzimas que catalizan pasos comprometidos en vías:
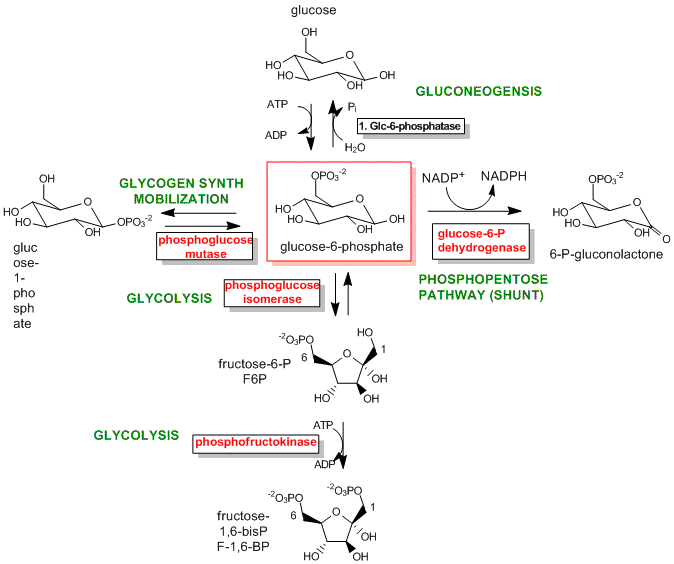
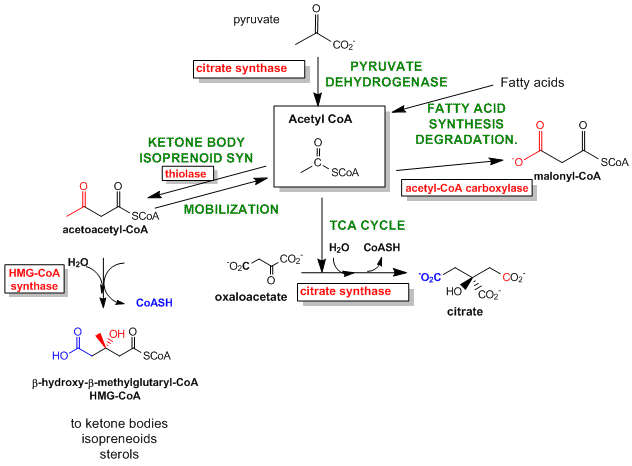
Las mejores enzimas para regular son las que catalizan el primer paso comprometido en la vía de reacción. El paso comprometido procede con una DG < 0 y es esencialmente irreversible. Estas reacciones a menudo ocurren a partir de intermedios metabólicos clave que están inmediatamente antes o proximales a las ramas en las vías de reacción. A continuación se muestran dos ejemplos.