2.1: Introducción
- Page ID
- 79269
Los iones metálicos juegan muchos papeles importantes en la biología. A veces estos papeles son estructurales: un ion metálico puede simplemente coordinarse con un átomo en una biomolécula que actúa como ligando, manteniendo la biomolécula en una forma particular. Las proteínas de dedos de zinc son un ejemplo ampliamente estudiado. En estos casos, un ion zinc se une a la proteína de tal manera que la proteína se mantiene en una forma particular. Generalmente, esta forma sirve para un propósito importante, como ser capaz de unirse más estrechamente a una molécula de ADN o incluso a una molécula pequeña.
- Los iones metálicos pueden contener proteínas y otras biomoléculas en formas particulares.
Para unirse al ion zinc, la proteína debe poseer átomos que sean capaces de actuar como ligandos. Muchos átomos en las proteínas pueden hacerlo potencialmente, incluyendo, ejemplo de abeto, el oxígeno carbonilo a lo largo de la cadena principal de la proteína. Sin embargo, es muy común que los residuos de aminoácidos específicos actúen como ligandos. Estos residuos tienen que estar ubicados en la posición correcta a lo largo de la cadena proteica. En el caso de las proteínas con dedos de zinc, un conjunto común de ligandos es un par de residuos de histidina y un par de restos de cisteína.
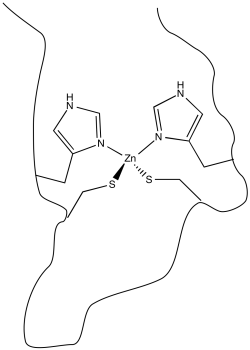
En otros casos, el ion metálico puede desempeñar el papel de un ácido de Lewis. Un sustrato que se une al metal se activa electrofílicamente; se vuelve más capaz de aceptar la donación de electrones de un nucleófilo. Los ejemplos incluyen alcohol deshidrogenasas y aldolasas, que a menudo contienen iones de zinc que coordinan carbonilos en el sustrato. El compuesto de carbonilo activado se somete a reacción más fácilmente.
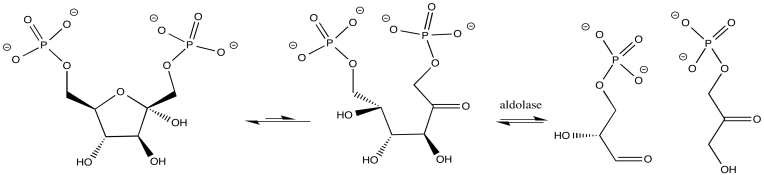
- Los iones metálicos pueden actuar como catalizadores ácidos de Lewis.
En muchos casos, los iones metálicos son redox activos. Pueden donar o aceptar un electrón de un sustrato. Alternativamente, pueden tomar parte en un relé de electrones, pasando electrones de uno a otro para lograr el transporte de electrones a larga distancia.
- Los iones metálicos pueden transferir electrones, uno a la vez, según sea necesario.
Las ferredoxinas son ejemplos de tales sitios redox activos en biología. Las ferredoxinas a menudo tienen una estructura de núcleo cúbico. Las esquinas de los cubos están compuestas por átomos alternantes de hierro y azufre. Las ferredoxinas y las estructuras relacionadas a menudo se denominan conglomerados de hierro y azufre.
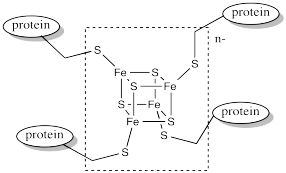
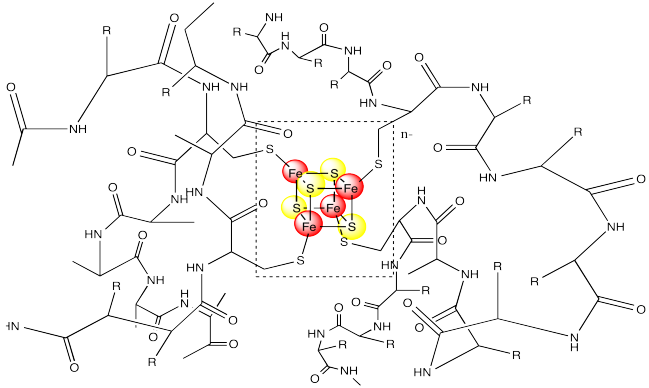
Observe que los átomos de hierro se mantienen en su lugar a través de la coordinación a una proteína circundante. En este caso, los átomos de hierro están unidos a residuos de cisteína. El centro metálico a menudo se encuentra enterrado dentro de la proteína, por lo que está completamente rodeado por los otros residuos de aminoácidos. Estas otras rediues pueden tener un impacto significativo en las propiedades del centro metálico, aunque no estén ligadas directamente a ningún metal.
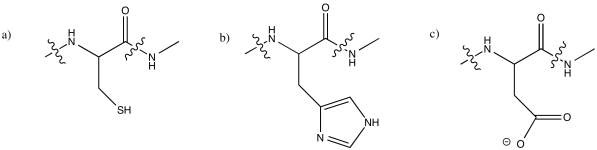
Los siguientes residuos de aminoácidos son los ligandos más comúnmente observados para iones metálicos en biología. Dibuja cada uno a pH 7.
a) cisteína b) histidina c) ácido aspártico
- Responder
-
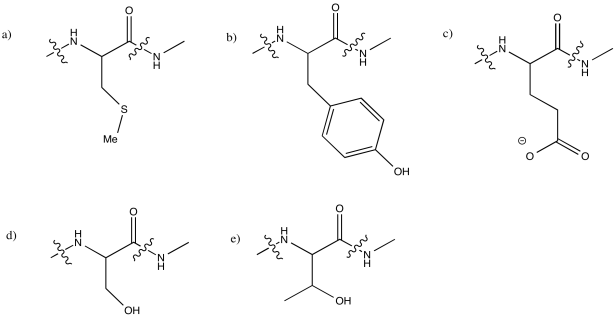
Aunque los siguientes residuos de aminoácidos no se observan tan comúnmente como ligandos para iones metálicos, a veces se encuentran en ese papel. Dibuja cada uno a pH 7.
a) metionina b) tirosina c) ácido glutámico d) serina e) treonina
- Responder
-
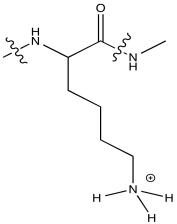
Generalmente no se observa que la lisina se coordine con iones metálicos en biología (aunque puede haber excepciones). Explique por qué, usando su estructura a pH 7.
- Responder
-
A pH neutro, la lisina normalmente estaría protonada. No tendría un par solitario en el nitrógeno para coordinar un ion metálico.
El potencial redox del ion metálico es de vital importancia. Los potenciales de reducción deben ser emparejados para que la transferencia de electrones ocurra fácilmente. La transferencia de electrones puede ser del metal al sustrato; en ese caso, el potencial de reducción del sustrato debe ser mayor (más positivo) que el del ión metálico. Se favorecerá la transferencia de electrones del metal al sustrato.
Por supuesto, si se transfiere un electrón del sustrato al ion metálico, lo contrario tendría que ser cierto. El potencial de reducción del ion metálico tendría que ser un poco más positivo que el del sustrato.
En un relé de electrones, necesitaríamos una serie de diferentes iones metálicos, cada uno con un potencial de reducción ligeramente más positivo que el anterior. De esa manera, los electrones seguirían pasando de un portador a otro, y viajarían en la dirección correcta, en lugar de dispersarse aleatoriamente.
Con el fin de mantener diferencias sutiles entre los potenciales de reducción de los centros metálicos, la Naturaleza ha desarrollado una amplia gama de estos complejos. A menudo, las diferencias entre estas especies implican sutiles variaciones en el ambiente de coordinación. Por ejemplo, en biología se conoce una amplia variedad de cúmulos de hierro y azufre; algunos de ellos se muestran a continuación.

- Las diferencias sutiles en la estructura de las metaloproteínas pueden conducir a diferencias sutiles en las propiedades redox.
Sin embargo, hay un aspecto más sutil en estos potenciales de reducción. En la mayoría de los casos, no debería haber una diferencia muy grande entre los potenciales de reducción de una especie y otra.
¿Por qué importa? ¿No parece que una gran diferencia en los potenciales de reducción significa que la transferencia de electrones es más exotérmica? ¿No debería ocurrir aún más fácilmente una reacción más exotérmica? ¿No es eso lo que queremos?
No, realmente, y hay un par de razones por las que. Una razón implica la eficiencia termodinámica y la pérdida de calor. Si una reacción es demasiado exotérmica, la energía desprendida por la reacción se pierde como energía térmica al entorno. Debido a que los organismos pasan gran parte de su tiempo tratando de recolectar energía para poder vivir, desperdiciar energía no es una buena idea.
La otra razón involucra la naturaleza catalítica o cíclica de muchos sistemas en biología. Podemos y hacemos rehacer muchas especies químicas necesarias para la actividad biológica de forma regular, pero si podemos reutilizar las cosas no tenemos que gastar la mayor parte de nuestra energía re-haciendo y consumiendo reactivos una y otra vez. Muchas especies simplemente se restablecen a su estado original para que puedan hacer su trabajo una vez más. Cuanto más fácil sea restablecer esa especie, más a menudo podrá seguir participando en un ciclo, haciendo el mismo trabajo una y otra vez.
En términos de transferencia de electrones, nos gustaría que el potencial de reducción de un aceptor de electrones sea lo suficientemente positivo para que acepte fácilmente un electrón de su donante. No obstante, queremos que pueda pasar su electrón a lo largo, y se prepare para aceptar otro. Eso significa que su potencial de reducción no puede ser demasiado positivo. Tiene que ser justo.
Por razones como estas, los potenciales de reducción en biología tienen que ser regulados finamente. Este problema es tan enormemente complicado como importante. En esta sección, vamos a echar un vistazo a algunos de los factores que pueden entrar en juego en la modulación de los potenciales de reducción en biología. Ciertamente no vamos a ganar mucha capacidad predictiva, porque se pueden involucrar demasiados factores y será difícil decidir qué factor es el más importante. Sin embargo, podremos entender algunas de las formas en que diferentes situaciones influyen en los potenciales de reducción.

