2.2: El efecto de la carga (efectos locales)
- Page ID
- 79270
Las reacciones de transferencia de electrones resultan en cambios en la carga. Por lo tanto, las cuestiones de estabilidad de carga son cruciales para determinar si se favorece o no una reacción. Si la donación de un electrón resultará en un aumento de la carga negativa en un complejo, entonces la donación puede ser inhibida. Eso es porque la acumulación de carga es energéticamente desfavorable. Por otro lado, si la donación de un electrón resultaría en disminución de la carga en el complejo, entonces la donación puede ocurrir con mayor facilidad.
- La carga local (incluyendo el átomo metálico y sus ligandos) puede influir en el potencial de reducción.
- A menudo, cuanto más cargado positivamente es el complejo de coordinación central en la metaloproteína (o cuanto menos carga negativa), mayor es su potencial de reducción.
Recuerde: este es solo uno de varios factores que podrían influir en el comportamiento de un complejo de coordinación. Aquí no se aplican reglas estrictas.
Calcular las cargas globales en los siguientes complejos metálicos, dado el estado de oxidación indicado en el metal.
- Ag I (NH 3) 2
- Fe II (H 2 O) 6
- Cu II (NH 3) 4
- Ag I Cl 2
- Co III (NH 3) 4 Cl 2
- Hg II I 4
- Fe II (CN) 6
- Co II (SCN) 4
- Cr VI O 4
- Co III (NO 2) 3 (NH 3) 3
- Co III (NH 2 CH 2 CH 2 NH 2) 2 Br 2
- Re I (CH 3) (CO) 5
Dadas las cargas globales sobre los siguientes complejos de coordinación, calcular el estado de oxidación del metal.
- [CuCl 4] 2-
- [Pt (NH 3) 4] 2+
- [Au (CN) 2] -
- [CrF 4] 2+
- [PtcL 6] 2-
- [FeCl (CN) 5] 3-
- [Pt (NH 2 CH 2 CH 2 NH 2) 2 Cl 2] 2+
- [Cu (CF 3) 4] -
- [Ni (C 2 O 4) 2 (H 2 O) 2] 2-
- [COCl (NO 2) (NH 3) 4] +
- [Co (NH 3) 4 SO 4] -
- [Ag (S 2 O 3) 2] 3-
Indicar las cargas sobre el complejo central en los siguientes sitios biológicos. (Toda la proteína tendría una carga, dependiendo de los residuos de aminoácidos; solo nos interesa la carga local que podemos ver aquí).

Al reducirse, el complejo se cargará más negativamente, porque está aceptando un electrón. Alternativamente, puede llegar a tener menos carga positiva. En cualquier caso, el electrón será más fácilmente aceptado en un complejo con una menor carga negativa para empezar. Acumulación de carga cuesta energía.
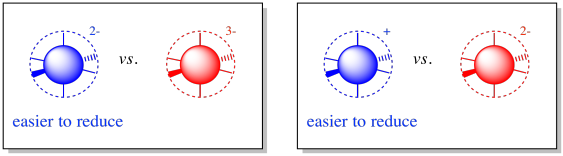
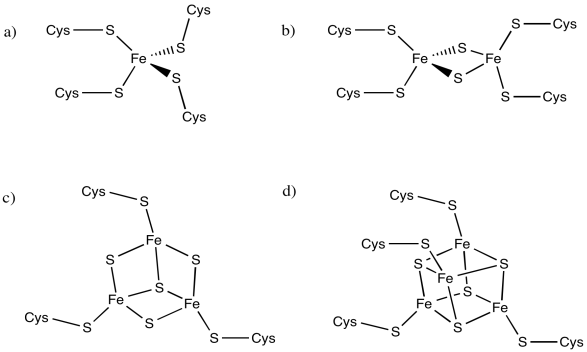
Un buen ejemplo de este efecto de carga se puede ver entre los racimos de hierro-azufre. Los conglomerados de hierro-azufre participan frecuentemente en vías de transferencia de electrones en biología. El rango de potenciales de reducción entre estas proteínas es bastante amplio, variando de -700 a +400 mV.
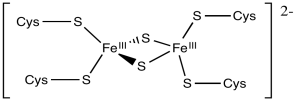
Típicamente, estos grupos contienen múltiples átomos de hierro y azufre y se mantienen en su lugar por restos de cisteína de una proteína circundante. Los átomos de azufre están presentes como aniones sulfuro (S 2-); generalmente hay dos o cuatro de ellos en el cúmulo. Los residuos de cisteína son típicamente desprotonados, por lo que actúan como aniones tiolato (RS -). El número de residuos de cisteína unidos al racimo varía. Por lo general hay un número suficiente para darle al hierro una geometría tetraédrica. Los átomos de hierro pueden estar presentes como Fe (II) o Fe (III), por lo que las cargas pueden variar. Podría haber dos, tres o cuatro iones de hierro en el cúmulo. Las combinaciones más comunes son dos átomos de hierro y dos de azufre o bien cuatro átomos de hierro y cuatro átomos de azufre.
Los centros de hierro Rieske son “proteínas de hierro de alto potencial”, lo que significa que tienen potenciales de reducción especialmente positivos. Tienen histidinas en lugar de cisteínas en algunas posiciones. En consecuencia, el complejo de coordinación central está más cargado positivamente, o al menos menos negativamente. Debido a que el complejo central está menos cargado negativamente, puede aceptar más fácilmente un electrón que otras proteínas de azufre de hierro.
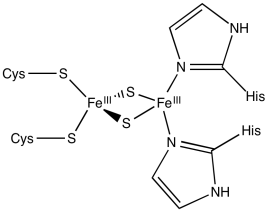
Calcular las cargas en los siguientes complejos hierro-azufre.
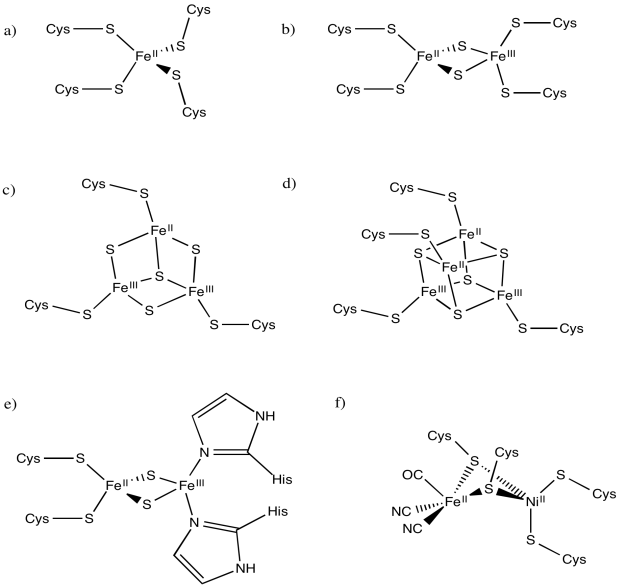
Los siguientes complejos de hierro tienen múltiples estados de oxidación posibles. ¿Cuál es el rango de posibles cargas en cada complejo, asumiendo que cada átomo de hierro podría ser Fe (II) o Fe (III)?
Con el fin de construir una mejor comprensión de las propiedades de las metaloproteínas, el laboratorio Pecoraro de la Universidad de Michigan ha estudiado la unión de péptidos sintéticos al cobre (J. Am. Chem. Soc. 2013, 135, 18096-18107.) Algunos de los péptidos sintéticos se muestran a continuación, junto con los potenciales de reducción para las especies de cobre unidas:
\[\ce{(peptide)_{3}Cu^{II} + e^{-} -> (peptide)_{3}Cu^{I}} \nonumber\]
| Péptido | Secuencia | E° |
| A | Ac-G WKALEEK LKALEE LKALEE H KAL K EK G-NH 2 | 504 mV |
| B | Ac-G WKALEEK LKALEE LKALEE H KAL Q EK G-NH 2 | 474 mV |
| C | Ac-G WKALEEK LKALEE LKALEE H KAL E EK G-NH 2 | 440 mV |
- El cobre se une a la histidina. Dibujar la estructura del sitio de unión.
- Calcular la carga local en el sitio de unión cuando se une a (i) Cu I y (ii) Cu II.
- Si la carga general en el complejo peptídico A 3 Cu II es cero, ¿cuáles son las cargas en (i) B 3 Cu II y (ii) C 3 Cu II?
- Sugerir una razón para el cambio en los potenciales de reducción entre los tres complejos.
- En comparación, el potencial de reducción del Cu II acuoso es de 159 mV. Sugerir una razón para la diferencia entre el potencial de reducción del cobre ácido y los complejos peptídicos.

