2.5: Consideraciones ácidas y bases duras y blandas
- Page ID
- 79297
Hay una serie de residuos de aminoácidos que comúnmente se unen a iones metálicos en biología. ¿Ciertos iones metálicos tienen preferencia por ciertos átomos donantes? ¿Y esos átomos donantes influyen en las propiedades de los complejos metálicos que se forman?
El principio de ácidos y bases duros y blandos (HSAB) es útil aquí. Recuerde, este es un sistema de clasificación que se basa en la cantidad de densidad de carga en ácidos y bases. Los iones pequeños con cargas apretadas se llaman “duros”. Los iones más grandes y polarizables se llaman “blandos”. Por lo general, los cationes duros (ácidos duros) se combinan más fácilmente con aniones duros (bases duras). Las bases blandas se combinan fácilmente con ácidos blandos.
¿Cuál de los siguientes cationes se consideraría difícil?
a) Hg + b) Ti 4+ c) Ca 2+ d) Cu +
- Contestar
-
Ti 4+ y Ca 2+
¿Cuál de los siguientes aniones se consideraría difícil?
a) F - b) I - c) CH 3 S - d) HO -
- Contestar
-
F - y HO -
Recuerde que en el caso de los cationes, el aumento de la carga positiva hace que el catión sea más pequeño, porque la carga positiva creciente atrae a los electrones restantes más cerca del núcleo. Eso significa que algunos metales podrían concebiblemente ser pensados como blandos en un estado de oxidación pero duros en otro. Un catión más altamente cargado sería más duro.
Algunos iones se colocan en la siguiente tabla para referencia, con especial atención a los casos que ocurren en biología.
| duro | limítrofe | suave | |
| ácidos | H +, Li +, Na +, K +, Mg 2+, Ca 2+, Co 3+, Fe 3+ | Fe 2+, Co 2+, Ni 2+, Cu 2+, Zn 2+ | Cu +, Ag +, Au +, Hg +, Cd 2+, Hg 2+ |
| bases | F -, HO -, H 2 O, Cl -, RO -, O 2 -, CH 3 CO 2 -, RNH 2, CO 3 2-, NO 3 - | NO 2 -, Br -, N 2, piridina, imidazol | RSH, RS -, S 2-, CN -, CO, I -, C 2 H 4, H -, CH 3 - |
Observe que algunos iones están entre las categorías duras y blandas. Estos ácidos limítrofes se unen más fácilmente con bases limítrofes.
Elige la mejor combinación para los siguientes iones.
- Co 2+ con CO 3 2-, NO 2 - o S 2-
- Mg 2+ con imidazol, CN - o CH 3 CO 2 -
- Cu + con RS -, piridina o H 2 O
- Fe 2+ con N 2, I - o HO -
- Zn 2+ con O 2 -, imidazol o RSH
- Contestar a
-
a) Co 2+ con NO 2 -
- Respuesta b
-
b) Mg 2+ con CH 3 CO 2 -
- Respuesta c
-
c) Cu + con RS -
- Respuesta d
-
d) Fe 2+ con N 2
- Respuesta e
-
e) Zn 2+ con imidazol
Muchos de los iones metálicos en la tabla anterior son biológicamente útiles. De la información de la tabla, no debería ser demasiado sorprendente que los iones Fe 2+ a menudo se unan a la histidina, que coordina con el metal a través de un grupo imidazol. Por otro lado, a veces los mismos metales en diferentes estados de oxidación pueden estar coordinados por otros residuos de aminoácidos. Por ejemplo, mayor estado de oxidación Fe 3+ puede tener más comúnmente donantes de aspartato o glutamato.
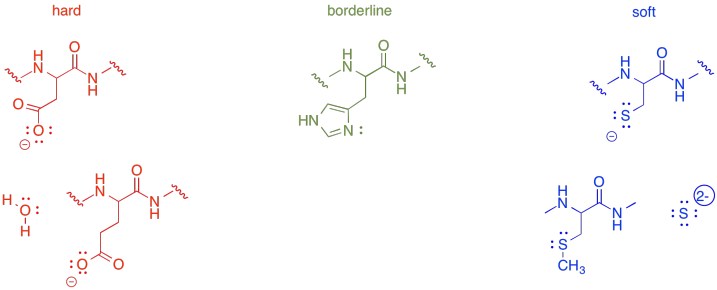
Elige la mejor combinación para los siguientes iones metálicos.
- Fe 3+ con asp, his o cys
- Cu + con glu, asp o met
- Zn 2+ con glu, his o cys
- Cu 2+ con su, H 2 O o S 2-
- Co 3+ con glu, cys o met
- Contestar a
-
a) Fe 3+ con asp
- Respuesta b
-
b) Cu + con met
- Respuesta c
-
c) Zn 2+ con su
- Respuesta d
-
d) Cu 2+ con su
- Respuesta e
-
e) Co 3+ con glu
Es importante familiarizarse con estas relaciones. Sin embargo, los iones metálicos rara vez se coordinan solo a un tipo de ligando en biología. Puede haber tres o cuatro tipos diferentes de aminoácidos unidos al mismo ion metálico en un complejo. No solo encontramos el mismo ion metálico unido al mismo aminoácido todo el tiempo.
¿Por qué es eso? Si el Fe 2+ forma los complejos más estables con la histidina, ¿por qué no se une simplemente a la histidina y a nada más? La respuesta es complicada, pero tiene algo que ver con el hecho de que el ion metálico se conformará con los aminoácidos que están disponibles en un sitio específico en la proteína. A veces el partido puede no ser el ideal. Eso es para nuestra ventaja, sin embargo. Después de todo, los iones metálicos no solo juegan papeles estructurales en biología. También se supone que deben hacer algo.
Muy a menudo, un ligando coordinado puede sintonizar la reactividad de un ion metálico. Lo hace no estabilizando el ion metálico en su estado actual sino estabilizando un estado alternativo, si tan solo el ion metálico sufriera una reacción para llegar allí. Una combinación de residuos de aminoácidos y otros ligandos pueden actuar juntos para mantener el ion metálico en un equilibrio fino entre dos estados de oxidación. Después de todo, una vez que un ion metálico ha reaccionado, necesita volver a la forma en que era antes. La célula no puede darse el lujo de seguir importando más oligoelementos solo para seguir adelante. Necesita reciclar sus reactivos a través de catálisis.
Elija el residuo de aminoácido que tendría el efecto sobre el ión metálico como se describe, con base en los principios de HSAB.
- Aumentar el potencial de reducción de Cu 2+: asp, his o met.
- Disminuir el potencial de reducción de Fe 3+: glu, his o cys.
- Hacer Cu + más fácil de oxidar: his, cys o met.
- Hacer que el Fe 2+ sea más fácil de oxidar: asp, his o cys.
- Haz que Fe 3+ sea más fácil de reducir: asp, glu o cys.
- Contestar a
-
a) Aumentar el potencial de reducción de Cu 2+: met.
- Respuesta b
-
b) Disminuir el potencial de reducción de Fe 3+: glu.
- Respuesta c
-
c) Hacer que el Cu + sea más fácil de oxidar: su.
- Respuesta d
-
d) Hacer que el Fe 2+ sea más fácil de oxidar: asp.
- Respuesta e
-
e) Hacer Fe 3+ más fácil de reducir: cys.

