4.2: Atadura de Oxígeno
- Page ID
- 79421
El oxígeno es vital para la vida. Los organismos muy pequeños pueden obtener suficiente oxígeno pasivamente de sus alrededores, pero los organismos más grandes y complicados necesitan tener mejores mecanismos para llevar oxígeno a las células. Los organismos de tamaño mediano como los insectos pueden lograr bombear aire a sus tejidos a través de un sistema de tubos que conducen desde los poros a lo largo de sus cuerpos. Los organismos más grandes que eso necesitan un sistema de circulación más complicado que involucre arterias y venas. El oxígeno se disuelve bastante bien en el agua, pero podemos obtener aún más oxígeno en nuestro sistema uniéndolo a moléculas portadoras.
La molécula portadora más común para el oxígeno, utilizada por vertebrados como nosotros, es la hemoglobina. La hemoglobina contiene un centro Fe (II) de cinco coordenadas en un ligando hemo o porfirina. En la imagen, solo se muestra el complejo de coordinación, despojado de la proteína circundante. Además, hay otros grupos unidos a la porfirina (el anillo que contiene nitrógeno) pero se dejan fuera de la imagen por simplicidad.

El oxígeno se une al hierro en el hemo, formando un complejo de hierro octaédrico. Esta forma se llama oxihemoglobina; la forma sin el oxígeno unido se llama desoxihemoglobina. Muchas cosas interesantes suceden como resultado de la unión de oxígeno, estructuralmente hablando. En primer lugar, el hemo cambia de forma. Para acomodar el cambio de una geometría plana pseudo-cuadrada a una octaédrica, la forma del hemo cambia de un cuenco distorsionado a un plano.

A veces, realizar un seguimiento de los estados de oxidación en los complejos de coordinación es más fácil si se utilizan formalismos de enlace dativo. En particular, si un arom donante es neutro, el enlace al metal se muestra usando un símbolo de enlace dativo. Esa es una flecha corta y recta desde el par de electrones donadores hasta el metal. Los enlaces entre los átomos donadores aniónicos y el metal se muestran como líneas cortas regulares, ya que normalmente dibujamos otros enlaces.
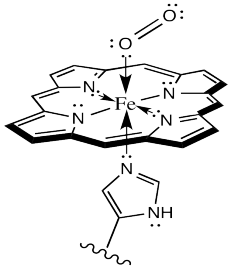
Al observar el complejo de esa manera, es más fácil ver que el átomo de hierro se representa como Fe (II); tiene dos donantes aniónicos de nitrógeno del anillo hemo. Analizaremos más de cerca la situación más adelante.
Dibujar d diagramas de división orbital para el centro de porfirina de hierro en desoxihemoglobina y en oxihemoglobina.
La hemoglobina es excepcionalmente buena para transportar oxígeno a los tejidos no sólo porque puede unir el hierro firmemente en las condiciones adecuadas, sino porque también puede soltar en las condiciones adecuadas, liberando oxígeno a los tejidos. Debido a que la hemoglobina es una proteína tan compleja, ha sido muy difícil de estudiar, aunque en los últimos años los investigadores han logrado avances impresionantes en el enarenado de proteínas.
En cambio, los químicos bioinorgánicos han desarrollado compuestos modelo para obtener información sobre la hemoglobina y otros compuestos biológicos importantes. Los compuestos modelo son compuestos relativamente simples que poseen una serie de características de sus primos más complicados. Por ejemplo, las porfirinas simples son relativamente fáciles de hacer; si quisieras estudiar la unión al oxígeno con un ejemplo sencillo, un complejo hierro-porfirina sería un gran complejo modelo.
El problema es que eso no funciona muy bien. Tal complejo une el oxígeno irreversiblemente; nunca lo suelta. Parte del problema es que el oxígeno “conecta” con otros complejos de hierro-porfirina, lo que no sucedería en la hemoglobina. En la hemoglobina, el hemo está enterrado y protegido dentro de la proteína.
Mostrar el complejo que resultaría si una molécula de oxígeno se puenteara entre dos complejos de porfirina de hierro.
El laboratorio de James Collman de la Universidad de Stanford ha estado involucrado en modelar la hemoglobina durante décadas. Lograron demostrar la unión reversible de oxígeno al complejo de porfirina “cerca de piquete” que se muestra a continuación. Los voluminosos grupos terc-butilo sirven para evitar que el oxígeno unido se puentee a otro complejo.

Eso por sí solo es un resultado interesante. Demuestra que uno de los muchos papeles para la proteína en este sistema es proteger estericamente el complejo hemo de hierro, modificando su reactividad.
Solo hay un pequeño problema. Se llama el valor M. El valor M es un índice de la discriminación entre la unión al oxígeno y la unión al monóxido de carbono. En realidad es la relación de las presiones parciales de los dos gases necesarios para semisaturar la hemoglobina (es decir, para que el 50% de los átomos de hierro tengan O 2 o CO unidos).
\[M - \frac{P_{1/2}^{CO}}{P_{1/2}^{O_{2}}} \nonumber\]
Cuanto menor sea el valor de M, mayor será la favorabilidad para la unión de O 2 en comparación con la unión de CO. En la hemoglobina, este valor es de aproximadamente 100, aunque variará de un organismo a otro. Eso significa que la hemoglobina se une al CO aproximadamente 100 veces mejor de lo que se une al O 2. Sin embargo, el heme de la cerca de piquete tiene un valor M superior a 25,000. Eso significa que es mucho más pobre en la unión de O 2, relativamente, que la hemoglobina.
¿Por qué preocuparse por la unión de CO en estos estudios? Por supuesto, la intoxicación por monóxido de carbono es un padecimiento grave y potencialmente mortal. Hay una consecuencia profundamente problemática del envenenamiento por CO, sin embargo, que podría ser mucho peor si el valor de M en un organismo fuera tan alto como en el piquete porfirina cerca. El CO es en realidad un producto de la descomposición normal de las moléculas hemo a lo largo del tiempo en la célula. Si nuestra hemoglobina tuviera un valor M como el de la porfirina cerca piquete, todos estaríamos muertos, envenenados por nuestros propios procesos metabólicos.
No contento con descansar en los laureles, el laboratorio de Collman volvió a la mesa de dibujo y desarrolló muchos otros complejos de modelos. Por ejemplo, el que se muestra a continuación tiene un valor M más cercano a 0.005.

¿Qué nos dice eso de la hemoglobina? Puede que no sea nada, pero podría estar indicando otro papel para la proteína circundante en la molécula de hemoglobina. El compuesto modelo abovedado o abovedado sugiere una cubierta protectora para el sitio de unión al oxígeno. ¿Es posible que O 2 pueda caber dentro pero el CO no?
Está bastante bien establecido a través de otros estudios modelo, así como el estudio directo de la oxihemoglobina, que cuando el oxígeno se une a un metal como el hierro, el Fe-O-O forma un ángulo de alrededor de 120°. El complejo tiene una geometría doblada. Sin embargo, cuando el CO se une a un metal, lo hace de manera lineal. Puede ser que en un complejo modelo abovedado, el CO simplemente no pueda pararse derecho, por lo que el complejo se desestabiliza. Presumiblemente, la proteína podría contribuir a una desestabilización similar de la hemoglobina unida a Co.

¿Por qué O 2 podría unirse de manera doblada mientras que los límites de CO en un modo lineal?
Esta idea ha sido algo polémica. Los resultados de los cálculos mecánicos cuánticos, por ejemplo, sugieren que el enlace Fe-C-O en realidad tiene una buena cantidad de margen de maniobra. Estos resultados sugieren que el CO puede ser “volcado” y aún permanecer fuertemente ligado. Sin embargo, los resultados de Collman proporcionaron un punto de partida útil para futuras investigaciones.
La proteína puede desempeñar otros papeles en la mejora de la selectividad al oxígeno. Los estudios cristalográficos de rayos X sugieren un papel para los enlaces de hidrógeno entre el sitio de “histidina distal” y el oxígeno unido. El sitio distal simplemente se refiere a una segunda histidina cercana, distinta a la que está unida al hierro (la “histidina proximal”), y un poco más lejos. Esa histidina podría estar idealmente situada en enlace de hidrógeno con oxígeno unido, pero fuera de lugar para una interacción óptima con un CO unido.

Hay un evento más importante a tener en cuenta en la unión de oxígeno. La evidencia indica que la oxihemoglobina es en realidad una especie de Fe (III), en lugar de Fe (II). El hierro es oxidado por el oxígeno unido.
Como siempre, es útil trazar un mapa del movimiento de los electrones, esquemáticamente, en este evento. Debido a que este evento sería una oxidación de un electrón, necesitamos un tipo diferente de flecha para mostrar a dónde van los electrones. La mayoría de nuestros mecanismos anteriores han involucrado pares de electrones en lugar de electrones simples. Para electrones simples, mostramos una flecha de una sola cabeza, en lugar de una de doble cabeza.
Aquí hay una manera de mostrar la oxidación del hierro (y la reducción del oxígeno):

O alternativamente, podríamos mostrarlo así:

Recuerde, en la estructura de la derecha, el oxígeno unido al hierro se considera un donante aniónico, mostrado con un enlace lineal regular en lugar de una flecha dativa.
Hay algo realmente asombroso en ese último evento. La hemoglobina no forma un complejo de oxígeno en absoluto. Forma un complejo con ión superóxido, O 2 -, que ha fabricado por sí mismo. Cuando está listo para ser entregado a las células, el superóxido devuelve el electrón al hierro, y se vuelve a convertir en una molécula de oxígeno cotidiana.
Describa con palabras lo que muestran las flechas curvas en los dos esquemas anteriores.
Explicar por qué la oxidación del hierro conduciría a una mayor unión del oxígeno.
Estudios de modelado de complejos de Cu (I) como el siguiente revelan que la exposición a O 2 da como resultado un complejo de peróxido de Cu (III) plano cuadrado (Tolman et al, J. Am. Chem. Soc. 2006, 128, 3445-3458 y sus referencias).
a) Dibujar el producto de la reacción.

b) Un complejo similar de cobre preparado con el siguiente ligando también se une a O 2, pero con una constante de unión en equilibrio mucho menor. Dibujar el complejo de cobre y el aducto O 2 y explicar la diferencia en las constantes de unión de O 2.

c) DBM (dopamina β-monooxigenasa) y una monooxigenasa de cobre similar, PHM (peptidilglicina α-hidroxilante monooxigenasa), ambos contienen átomos de cobre unidos a dos histidinas, una cisteína y una agua. Explique la elección de los investigadores de los compuestos modelo anteriores en este contexto.
d) Explicar cómo la cisteína en estos sitios activos podría ayudar a controlar los niveles de radicales OH en la célula.

