5.4: Estudios Modelo para la Unión de Nitrógeno
- Page ID
- 79228
Si se va a reducir el nitrógeno, primero se tiene que unir. Sin embargo, el nitrógeno es notablemente inerte. Los químicos realizan reacciones rutinariamente bajo una atmósfera de nitrógeno puro debido a su falta de reactividad. Las compañías químicas finas embotellan compuestos bajo nitrógeno para garantizar que el contenido permanezca en perfectas condiciones mientras está sentado en la repisa. Si el nitrógeno no reacciona con nada, ¿cómo reacciona con un átomo de hierro en la nitrogenasa?
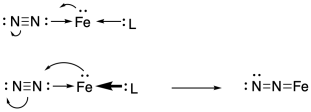
¿Cuál es la debilidad de la molécula de dinitrógeno? Eso resulta estar relacionado con su fortaleza. El triple enlace nitrógeno-nitrógeno enormemente fuerte está compuesto por un enlace sigma y dos enlaces pi. El orbital antiunión correspondiente permite que el nitrógeno actúe como aceptor pi.
Eso significa que hay una buena probabilidad de que la molécula de nitrógeno no reactiva se una a un metal de transición. Un orbital d ocupado en un átomo de hierro podría volver a donar a ese orbital de nitrógeno, manteniendo el dinitrógeno de manera más segura en el hierro. El nitrógeno se puede unir.

Solo para hacer que ese escenario sea más probable, el metal podría afinarse para maximizar su capacidad de backbond con el nitrógeno. Eso significa que necesita mucha densidad de electrones. Un átomo de metal rico en electrones donaría fácilmente densidad de electrones al orbital aceptor pi de nitrógeno. Entonces el nitrógeno se uniría más fuertemente.
Un factor que ayudaría es un bajo estado de oxidación. Un bajo estado de oxidación en el metal lo dejaría con más densidad de electrones para donar al orbitario aceptor de nitroge pi.
Un factor secundario es la fuerte donación de ligandos auxiliares. Estos otros ligandos jugarían un papel de apoyo al prestar densidad electrónica adicional al metal de transición para que pudiera unirse al nitrógeno aún más estrechamente.
Al igual que con otras metaloproteínas, los investigadores han dedicado mucho esfuerzo al estudio de la nitrogenasa. También han invertido una tremenda cantidad de esfuerzo estudiando compuestos modelo. Los compuestos modelo son moléculas más simples que incorporan aspectos seleccionados de la metaloproteína. Al diseñar intencionalmente un compuesto modelo para incluir ciertas características del centro metálico en la proteína, los investigadores pueden evaluar qué papel juegan esas características en la reactividad de la metaloproteína.
Es bastante obvio que podríamos querer un compuesto modelo para que la nitrogenasa contenga átomos de hierro. Después de todo, la nitrogenasa contiene varios átomos de hierro en su sitio activo. Por supuesto, también contiene molibdeno, o en algunos casos vanadio. Un compuesto modelo podría contener esos átomos, en su lugar. Alternativamente, podría contener átomos distintos de los que se encuentran en la enzima nativa. Eso sería una especie de enfoque de “pushing-the-sobre”. Si un metal rico en electrones es importante, ¿qué tan rico en electrones podemos ir? ¿O qué tan pobres en electrones podemos obtener y aún así poder unir nitrógeno? Al explorar cosas que no forman parte del sistema natural, podríamos ver mejor la importancia de esas cosas que son.
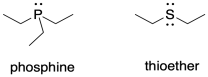
Lo mismo ocurre con los ligandos auxiliares, aquellos que soportan el metal pero que pueden no estar directamente involucrados en la catálisis. Los sulfuros ricos en electrones en la nitrogenasa pueden ser una parte importante de un compuesto modelo. Así lo podrían hacer las fosfinas, cuyos átomos donantes de fósforo son de un tamaño similar al azufre. Las fosfinas son comúnmente utilizadas industrialmente en catálisis organometálica y podrían hacer buenos imitadores de los ligandos de azufre en la nitrogenasa.
Considere el tipo de ligando que presenta una fosfina en comparación con un tioéter. ¿Cuál podría ser la desventaja de usar una fosfina como sustitutivo de un donante de azufre?
- Contestar
-
Dicho todo eso, vale la pena enfatizar que la unión de nitrógeno aún no es fácil. A veces, los investigadores que quieren estudiar el potencial de unión de nitrógeno en un complejo determinado comienzan con la unión de monóxido de carbono en su lugar. ¿Por qué monóxido de carbono? En primer lugar, es mucho más fácil de unir que dinitrogen. Es un aceptor pi mucho más fuerte, debido a que el orbital antiadhesión pi está mucho más fuertemente ubicado en el carbono que sigma dona al metal. Por supuesto, es posible que ya sepas que hay algunas reacciones importantes de metales de transición que implican unir y reducir el monóxido de carbono.
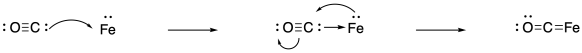
Además, los estudios de monóxido de carbono pueden ser útiles porque el monóxido de carbono actúa como un “ligando indicador”. Es fácilmente monitoreado por espectroscopía IR, por ejemplo. Dinitrogen es un candidato pobre para el estudio de IR debido al enlace N-N no polar. (Se puede observar mediante espectroscopia Raman, que da información similar pero es un poco más complicada de ejecutar). El enlace CO se detecta fácilmente en el espectro IR, se encuentra en una región que no suele estar abarrotada con otros picos de otros enlaces, y es bastante sensible al estado de oxidación del metal. Eso es debido a la fuerte unión posterior de un orbital d de metal lleno en el orbital antiadhesión pi del monóxido de carbono. Cuanto más retro-donación del metal, más débil es el enlace CO, resultando en una caída en la frecuencia en el espectro IR.
Clasificar las siguientes especies en términos de su frecuencia de estiramiento de CO en el espectro IR.

El nitrógeno puede unirse a los metales de varias maneras. Dibuje estructuras que ilustren los siguientes modos de enlace:
a) un ligando de nitrógeno terminal unido al extremo unido a través de un par solitario
b) un ligando de nitrógeno terminal unido por medio de donación a partir de un enlace pi
c) un ligando de nitrógeno puente unido al extremo unido a través de un par solitario
d) un ligando de nitrógeno de enlace lateral unido mediante donación a partir de un enlace pi
e) un ligando de nitrógeno puente unido mediante donación a partir de un enlace pi y un par solitario
Al nombrar compuestos de coordinación, a veces se utilizan los prefijos eta (η) y mu (μ) para indicar modos de unión a ligandos como los descritos anteriormente.
Eta describe el número de átomos de ligando unidos a un solo átomo de metal, y generalmente se usa cuando hay enlaces pi que podrían donar, acercando dos o más átomos donantes al metal.
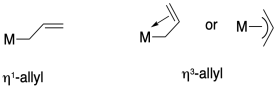
Mu se usa para indicar un ligando puente, y si le sigue un número puede describir el número de átomos metálicos puenteados por un ligando.
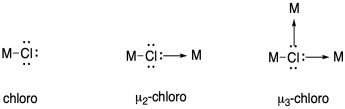
Utilice estas notaciones para describir los modos de unión de nitrógeno en la pregunta anterior.
Ejercicio\(\PageIndex{5}\)
El laboratorio de Jonas Peters (Caltech) ha desarrollado un nuevo sistema en un intento de modelar el efecto de un átomo de carbono reportado en la estructura del cofactor Fe/Mo de la nitrogenasa (J. Am. Chem. Soc. 2014, 136, 1105-1115). El sistema produce catalíticamente amoníaco en presencia de N 2, ácido y Na.
a) Rellenar los estados de oxidación.
b) Rellenar los reactivos faltantes.
c) Rellenar d diagramas de división orbital.
d) Explicar las diferencias en las frecuencias de estiramiento N-N.
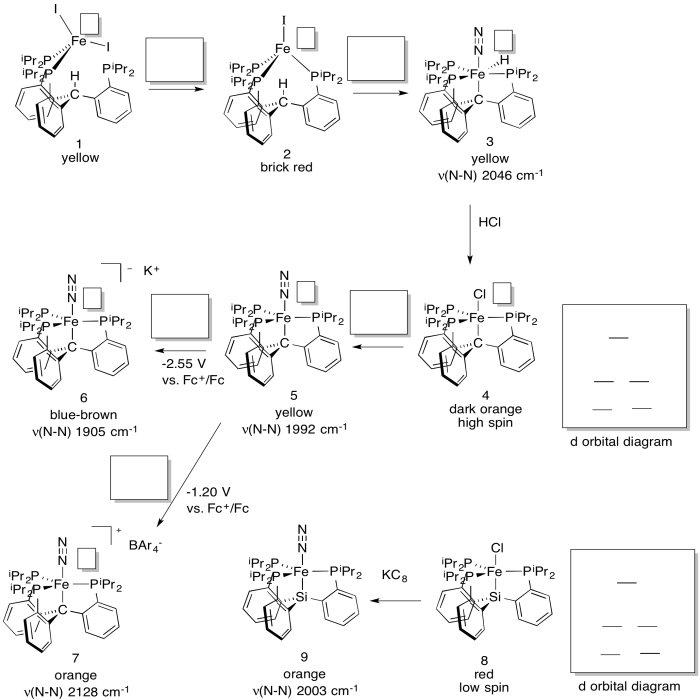
- Contestar
-
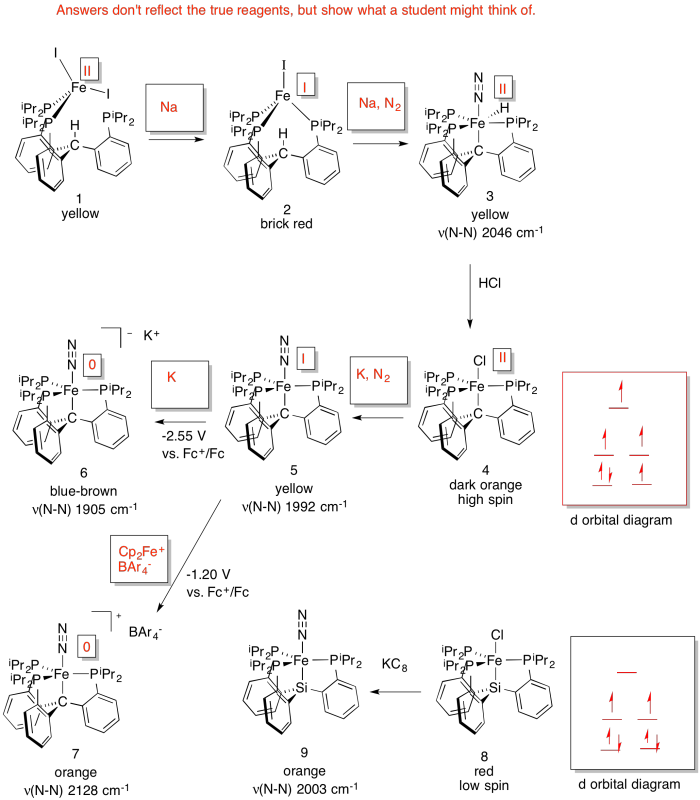
d) A medida que el Fe se reduce, la frecuencia de estiramiento N-N disminuye. Eso es porque cuanto más densidad de electrones hay en el Fe, más es capaz de retrounir al N 2 (N 2 es un aceptor π).

