5.3: Nitrogenasa
- Page ID
- 79233
Varios organismos participan en el ciclo del nitrógeno, pero desde el punto de vista de la química, los diazótrofos han recibido la mayor atención. Eso se debe en parte a que su conversión de nitrógeno atmosférico en amoníaco refleja la maravilla del siglo XX del Proceso Haber-Bosch, que ha sido responsable de un tremendo incremento en la producción mundial de alimentos durante el último siglo.
El centro de fabricación de amoniacodel diazótrofo es la nitrogenasa. La siguiente imagen está tomada de una estructura cristalina de rayos X de la enzima (referencia citada al final de la página). En lugar de mostrar los átomos individuales, como lo hacen normalmente las estructuras de rayos X (excepto los hidrógenos, que son demasiado pequeños para detectarlos), la estructura se representa en forma de caricatura. La imagen de caricatura de una proteína está destinada a transmitir subestructuras clave: las partes rosadas son hélices α-hélices, las cintas amarillas son β-hojas y los hilos blancos son bucles.
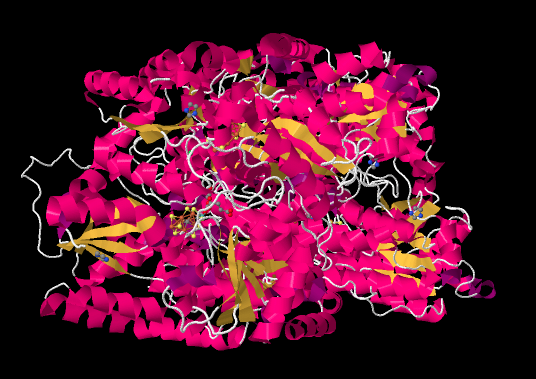
Si eliminamos toda la proteína de la imagen —es decir, la cadena de aminoácidos que componen la nitrigenasa—, entonces nos quedan algunos “ligandos”. Los ligandos en este contexto son simplemente otras moléculas o iones que se encuentran dentro de la proteína; a menudo los ligandos están unidos a cadenas laterales de aminoácidos. Al observar los ligandos a continuación, podemos ver que la nitrogenasa es en realidad un dímero. El grupo de moléculas en la mitad izquierda de la imagen es el mismo que el grupo de moléculas en la mitad derecha de la imagen, aunque se rotan boca abajo con respecto a las demás.
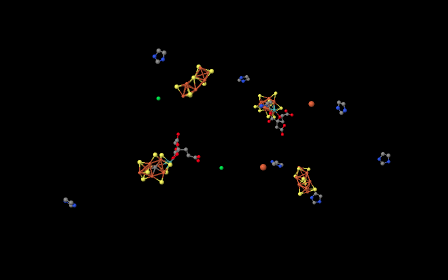
Un par de las estructuras de la imagen de arriba son iones metálicos; parecen bolitas. Para obtener una mejor visión de las otras estructuras, acerquemos un poco más.
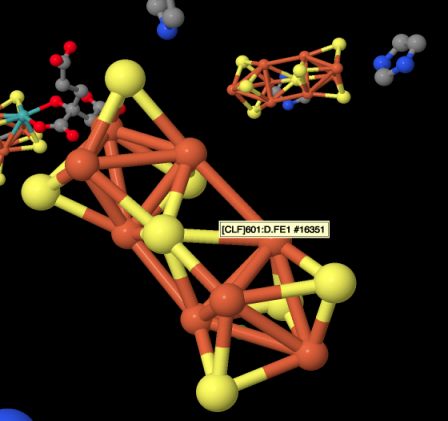
Eso es un cúmulo de hierro y azufre que fotobombardea la imagen. Las esferas rojas están codificadas por colores para el hierro, mientras que las esferas amarillas están codificadas por colores para el azufre. Las barras entre los átomos pueden o no representar enlaces; la difracción de rayos X realmente no detecta enlaces, solo los átomos altamente densos en electrones, sino que el software inserta enlaces cuando detecta átomos que están muy juntos. Los enlaces hierro-azufre son ciertamente reales. Los enlaces rojos mostrados entre los átomos de hierro probablemente no son reales, aunque existe la posibilidad de acoplamiento magnético entre los átomos de hierro dentro del cúmulo. A continuación se proporciona un dibujo del cúmulo. El dibujo también incluye donantes de azufre adicionales en los átomos de hierro, pero esos son de residuos de cisteína en la proteína, que se ha vuelto invisible en la imagen de arriba.
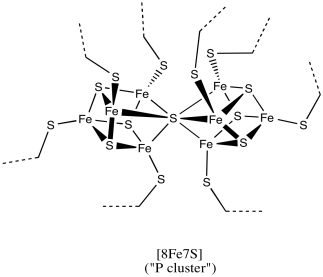
Este grupo en particular contiene 8 átomos de hierro y 7 iones sulfuro (S 2-); se le conoce como un racimo [8Fe7S] para abreviar. Los racimos de hierro y azufre son en realidad bastante comunes en biología. Probablemente el más común es un clúster [4Fe4S], aunque a menudo también se ven clústeres [3Fe4S] y [2Fe2S]. Los racimos de hierro y azufre suelen estar cargados. La cantidad de carga en los cúmulos globales depende de los estados de oxidación de los átomos de hierro. Los estados de oxidación pueden cambiar debido a que estos clústeres funcionan como relés de electrones. Pueden aceptar un electrón de otra parte de la proteína y enviarlo a donde sea necesario.

Ejercicio\(\PageIndex{1}\)
Indicar los cargos en los siguientes clústeres.
- [4Fe4S], con dos Fe 2+ y dos Fe 3+
- [3Fe4S], con dos Fe 3+ y un Fe 2+
- [2Fe2S], con un Fe 2+ y un Fe 3+
- Contestar a
-
a) S: 4 x 2 - = 8 -; CYS: 4 x 1 - = 4 -; Fe: 2 x 2 + + 2 x 3 + = 10 +; total = 2 -
- Respuesta b
-
b) S: 4 x 2 - = 8 -; CYS: 3 x 1 - = 3 -; Fe: 1 x 2 + + 2 x 3 + = 8 +; total = 3 -
- Respuesta c
-
c) S: 2 x 2 - = 4 -; CYS: 4 x 1 - = 4 -; Fe: 2 + + 3 + = 5 +; total = 3 -
También hay un par de histidinas visibles en la imagen de arriba. Probablemente se introdujeron cuando los investigadores estaban cultivando los cristales. A la izquierda apenas se ve una estructura mucho más interesante. Ese es en realidad el cofactor hierro-molbdeno o Fe-Mo, también llamado racimo M. Es el sitio de reducción de nitrógeno en la enzima. A continuación se proporciona una visión mucho más clara de esta estructura. Debido a que estamos viendo un dímero, podemos ver un segundo cúmulo M detrás.
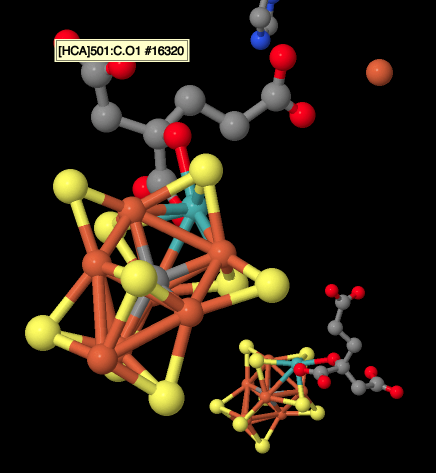
A continuación se muestra un dibujo del cúmulo M. Tiene cierto parecido con [8Fe7S]. Esta vez, se cree que el átomo en el centro es un carbono. Un trío de sulfuros adicionales puente entre los dos cubos, y en una esquina un átomo de hierro ha sido reemplazado por un molibdeno.
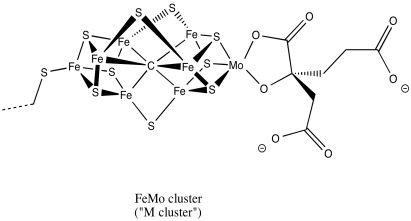
Aquí hay una imagen del cúmulo M desde un ángulo diferente. El molibdeno con su ligando unido se encuentra en la parte superior izquierda, coordinado por sulfuros amarillos. El átomo gris en el medio es probablemente un átomo de carbono.
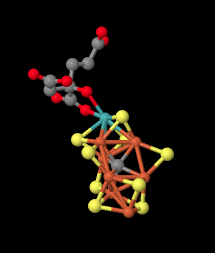
El mecanismo por el cual la nitrogenasa reduce el nitorgeno a amoníaco es probablemente algo diferente del mecanismo en el Proceso Born-Haber. En lugar del tratamiento con gas hidrógeno, bajo condiciones biológicas es probable que el mecanismo implique la reducción a través de electrones y protones individuales. Exactamente cómo llegan los electrones y protones a su destino es una pregunta interesante.
Una posibilidad es que el dinitrógeno se reduzca un electrón y un protón a la vez. Los clústeres de FeS serían capaces de entregar electrones a través de un relé de electrones que corre a través de la célula. Los residuos de aminoácidos en la proteína serían capaces de lanzar protones según sea necesario.
Ejercicio\(\PageIndex{2}\)
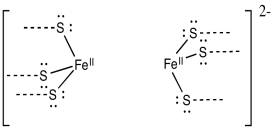
Proporcionar un mecanismo para la reducción de dinitrógeno, N 2, a diazeno, HN=NH, a través de adiciones alternas de electrones y protones. Supongamos que el siguiente modelo es el sitio de la reacción, con donantes apropiados de electrones y protones cerca.
- Contestar
-

Alternativamente, el proceso podría parecerse más al Proceso Haber-Bosch, utilizando el mecanismo de reacción “organometálico” clásico como la adición oxidativa, inserción y eliminación reductora. De hecho, la evidencia reciente sugiere que el H2 puede ser producido por algunas nitrogenasas bajo condiciones biológicas. Esa observación es congruente con el funcionamiento de este tipo de mecanismos.
Ejercicio\(\PageIndex{3}\)
Mostrar cómo la protonación de un átomo de hierro es equivalente a una adición oxidativa.
- Contestar
-

Ejercicio\(\PageIndex{4}\)
Proporcionar un mecanismo para la reducción de dinitrógeno, N 2, a diazeno, HN=NH, a través de una serie de etapas organometálicas (asociación/disociación, adición oxidativa/eliminación reductiva, inserción/eliminación).

- Contestar
-


