6.1: Introducción a los radicales
- Page ID
- 79188
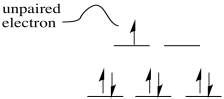
Los radicales son especies que tienen electrones desapareados. Pueden ser átomos o moléculas y pueden ser especies neutras o iones. Frecuentemente, los radicales son muy reactivos. Sin embargo, su modo de reactividad no se encuentra perfectamente dentro de los patrones normales de ácidos y bases de Lewis, o nucleófilos y electrófilos.
Los radicales juegan un papel común en la química atmosférica, incluyendo el equilibramiento de la capa de ozono. También se encuentran en una variedad de vías bioquímicas. Además, los radicales se emplean en una serie de procesos útiles, como la polimerización de metacrilato de metilo o cloruro de vinilo, comúnmente utilizados para hacer “vidrio” resistente a roturas y tuberías para plomería, respectivamente.
Los compuestos de los elementos del bloque p forman radicales si uno de los átomos tiene siete electrones en su caparazón de valencia en lugar de los ocho habituales.
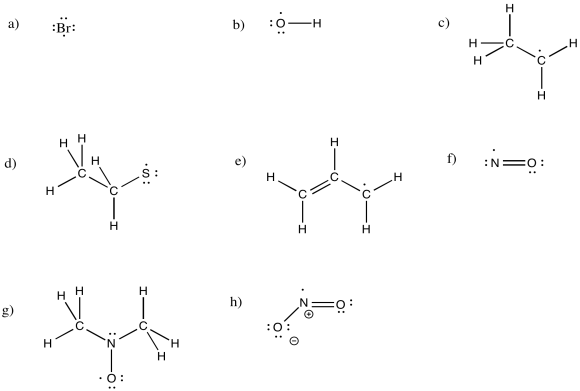
Dibuje estructuras para los siguientes radicales neutros, asegurándose de rellenar el número correcto de electrones.
a) Br b) OH c) CH 3 CH 2 d) CH 3 CH 2 S e) CH 2 CHCH 2 f) NO g) (CH 3) 2 NO h) NO 2
- Contestar
-
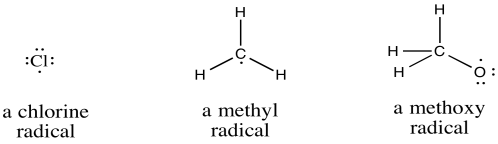
Una molécula podría convertirse en radical de varias maneras diferentes. Un enlace puede romperse por la mitad mediante la adición de energía, ya sea en forma de calor o luz. De lo contrario, puede simplemente transferir uno de sus electrones a otra parte. Nuevamente, este evento puede precipitarse por la adición de calor o energía lumínica. Por supuesto, una molécula que recibe un electrón adicional de otra parte también puede convertirse en un radical.
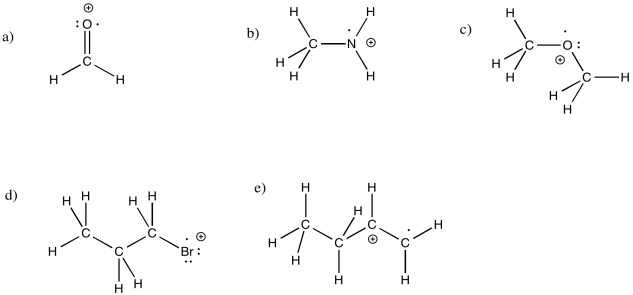
Dibuje estructuras para los siguientes radicales catiónicos, asegurándose de rellenar el número correcto de electrones y la carga formal.
a) H 2 C=O b) CH 3 NH 2 c) CH 3 OCH 3 d) CH 3 CH 2 CH 2 Br e) CH 3 CH 2 CHCH 2 CHCH 2
- Contestar
-
Dibuje estructuras para los siguientes radicales aniónicos, asegurándose de rellenar el número correcto de electrones.
a) O 2 b) H 2 CO c) CH 3 CCCH 3 d) Ciclo-c 6 H 6
Los compuestos anteriores son todos radicales simples, que contienen un electrón desapareado. Los compuestos también pueden tener más de un electrón desapareado.
El oxígeno elemental, O 2, es un diradical. Aunque su estructura de Lewis no sugiere nada inusual, su diagrama orbital molecular revela que el oxígeno en realidad tiene dos electrones desapareados.
Mostrar dos estructuras de Lewis para O 2: una ilustrando su doble enlace y la otra ilustrando su carácter diradical.
- Contestar
-

Mostrar, con un diagrama de interacción orbital molecular, el carácter diradical del dioxígeno.
- Contestar
-
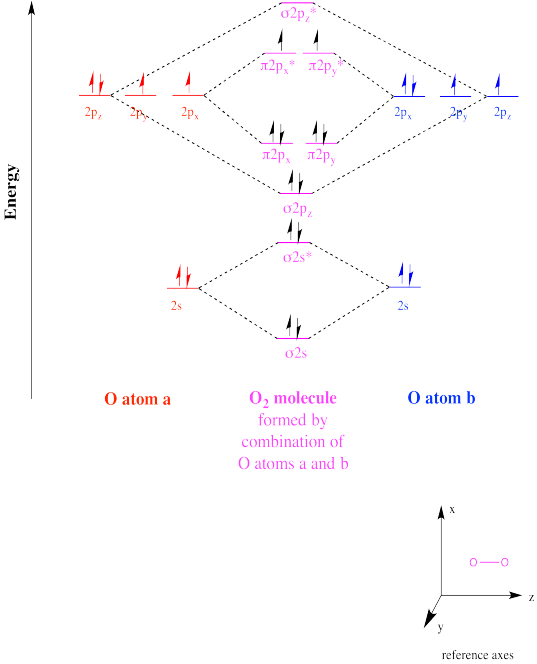
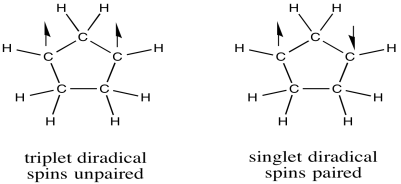
Un diradical podría tomar dos formas diferentes. Por ejemplo, el oxígeno molecular tiene dos orbitales moleculares solo ocupados. El electrón único en cada uno de esos orbitales podría adoptar uno de dos estados de espín diferentes. Ambos podrían adoptar el mismo estado de giro (designado con la flecha “arriba”, por ejemplo), o podrían ser “spin-pareados” (uno “arriba”, uno “abajo”). A la primera situación se le llama “estado triplete”, mientras que al segundo caso se le denomina “estado singlete”. Estas dos situaciones dan como resultado algunas diferencias físicas, como diferentes interacciones con un campo magnético.
Las páginas posteriores se centrarán en la reactividad de los radicales, con énfasis en las etapas de las reacciones radicales en cadena.
Algunos compuestos de metales de transición tienen características radicales. Mostrar por qué, utilizando como ejemplo un complejo Co (II) de bajo espín en un ambiente octaédrico.
- Contestar
-