6.2: Iniciación radical - Homólisis de enlace
- Page ID
- 79194
A veces, los radicales se forman porque un enlace covalente simplemente se divide por la mitad. Dos átomos que solían estar unidos entre sí van por caminos separados. Cada átomo lleva consigo un electrón del enlace anterior. Este proceso se llama homólisis, lo que significa que el enlace se está rompiendo de manera uniforme. En contraste, heterólisis es el término para un enlace que se rompe por ionización, con un átomo obteniendo ambos electrones del enlace.
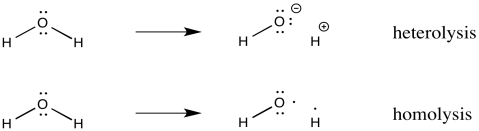
- La homólisis describe romper un enlace por la mitad, con un electrón que va a cada lado del enlace anterior.
En imágenes, mostramos este proceso usando flechas curvas, pero las flechas que usamos son ligeramente diferentes de las que puedes estar acostumbrado a ver en la química de reacciones polares. En lugar de una punta de flecha regular, usamos media punta de flecha. Este tipo de flecha se parece un poco más a un anzuelo. Es fácil recordar los papeles de los dos tipos de flechas, porque una punta de flecha completa describe el movimiento de un par de electrones, mientras que una media punta de flecha describe el movimiento de un solo electrón.
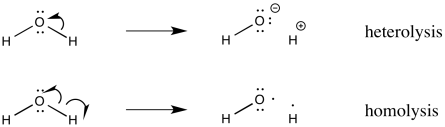
¿Por qué un enlace covalente simplemente se rompería? Realmente hay una serie de factores y una serie de eventos que pueden derivar en esta situación. La parte sencilla de la historia es que el vínculo debió haber sido débil en primer lugar. Había suficiente energía disponible en forma de calor transferido del entorno (o a veces en forma de luz) para superar la energía de estabilización del enlace.
¿Qué hace que un vínculo sea débil o fuerte? Esa es una pregunta complicada. Muchos factores influyen en la fuerza de unión. Sin embargo, dos de los principales factores responsables de la fuerza del enlace covalente son el grado de intercambio de electrones debido a la “superposición” y el grado de polaridad del enlace resultante del “intercambio”. La mayoría de los enlaces covalentes fuertes se basan en una mezcla de estos dos factores.
Una característica bastante común en la homólisis es un enlace entre dos átomos del mismo tipo. Por ejemplo, los halógenos elementales a menudo se someten a homólisis con bastante facilidad. La facilidad con la que estos enlaces se pueden dividir por la mitad se ilustra por sus bajas energías de disociación de enlaces. No se necesita agregar mucha energía para poder superar los vínculos entre estos átomos.
| Bond | Energía de disociación de enlace (kcal/mol) |
| H-H | 105 |
| C-C | 85 |
| N-N | 65 |
| O-O | 47 |
| F-F | 37 |
| S-S | 45 |
| Cl-Cl | 57 |
| Br-Br | 45 |
| Sn-Sn | 45 |
| I-I | 35 |
Esta propensión a la formación de radicales se puede entender en términos de la falta de un componente polar en estos enlaces. Estos átomos se basan únicamente en la superposición atómica para compartir electrones entre sí.
Hay una notable excepción a la regla de que los enlaces homoatómicos son inherentemente débiles, y eso es un enlace carbono-carbono. Su energía de disociación de enlaces se enumera en la tabla para su comparación con los halógenos. La fuerza relativa de los enlaces carbono-carbono da lugar a una multitud de compuestos “orgánicos” a base de carbono en la naturaleza. La formación de enlaces entre átomos similares se llama “catenación”; el carbono es el campeón mundial.
Dibujar estructuras para los siguientes reactivos y mostrar flechas curvas para ilustrar la iniciación de radicales en cada caso.
a) Br 2 b) H 2 O 2 c) (CH 3) 3 CO 2 H d) (CH 3) 2 SBSb (CH 3) 2 e) CH 3 CH 2 CH 2 CH 2 SSCH 2 CH 2 CH 2 CH 3
El silicio (BDE Si-Si = 53 kcal/mol) y el azufre (BDE S-S = 54 kcal/mol) también son capaces de catenación, pero los enlaces que estos átomos forman entre ellos son mucho más débiles que los enlaces C-C. Parece ser generalmente cierto que los átomos más grandes forman enlaces más débiles, al menos en el grupo principal de la tabla periódica. Después de todo, los enlaces I-I son más débiles que los enlaces Br-Br, que son más débiles que los enlaces Cl-Cl.
A veces se argumenta que esta tendencia es el resultado de una mala superposición espacial entre los orbitales p más difusos más cercanos al fondo de la tabla periódica. Sin embargo, no se debe ignorar el otro lado de la ecuación. Una vez que se rompen estos vínculos, se forman dos nuevos radicales. Así como los iones son más estables en átomos más grandes y polarizables, también lo son los radicales.
- Los radicales son más estables en átomos más grandes y polarizables.
- Por ejemplo, los radicales de azufre son más estables que los radicales de oxígeno.
Estas tendencias se muestran en una comparación de las resistencias de enlace carbono-halógeno. El enlace carbono-yodo promedio es mucho más débil que el enlace carbono-flúor promedio.
| Bond | BDE (kcal/mol) |
| C-F | 116 |
| C-Cl | 78 |
| C-Br | 68 |
| C-I | 51 |
Otros factores que estabilizan los radicales también pueden inclinar eventos a favor de la homólisis de enlaces. Por ejemplo, durante las hidrogenaciones catalíticas, los enlaces éter en las posiciones bencílicas a menudo se escinden. Un enlace C-O no es inherentemente débil, pero un radical bencílico es bastante estable. Es la estabilidad del radical resultante lo que debilita este enlace C-O particular y permite que se rompa con tanta facilidad.
- Los radicales particularmente estables se forman con relativa facilidad.
- Por ejemplo, los radicales bencílicos se forman muy fácilmente.
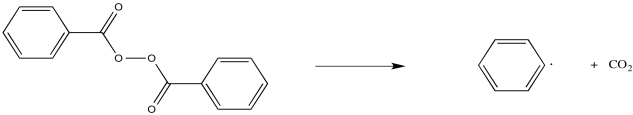
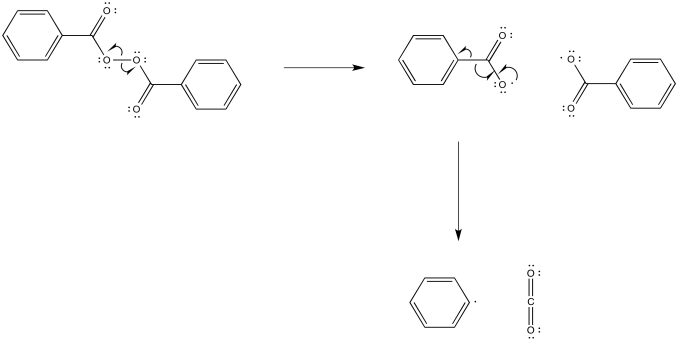
Algunos compuestos se utilizan comúnmente como iniciadores de radicales. Por ejemplo, los peróxidos contienen enlaces O-O débiles que pueden escindirse para formar radicales. Ese es el evento inicial en la formación de un radical a partir del peróxido de benzoilo, pero el radical carboxilo resultante se descompone rápidamente a favor de la formación de dióxido de carbono.
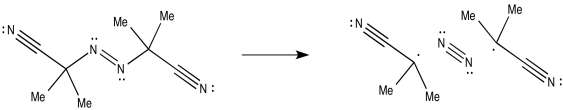
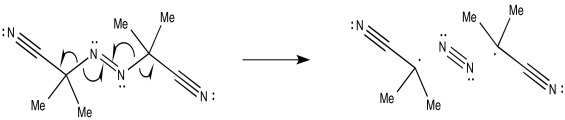
El AIBN, por otro lado, puede escindirse para producir un triple enlace dinitrógeno muy fuerte, dejando atrás dos radicales.
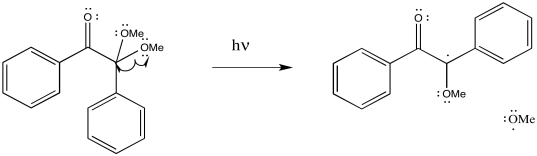
El DMPA es un fotoiniciador; se escinde por la adición de luz.
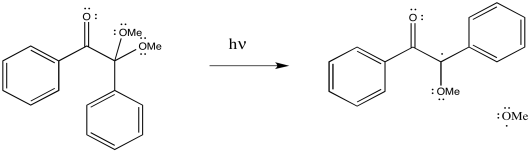
Proporcionar mecanismos para la formación de radicales a partir de
a) peróxido de benzoilo b) AIBN c) DMPA
- Contestar a
-
a)
- Respuesta b
-
b)
- Respuesta c
-
c)
Los siguientes iniciadores forman radicales con relativa facilidad. Proporcionar mecanismos para la formación de radicales en cada caso.
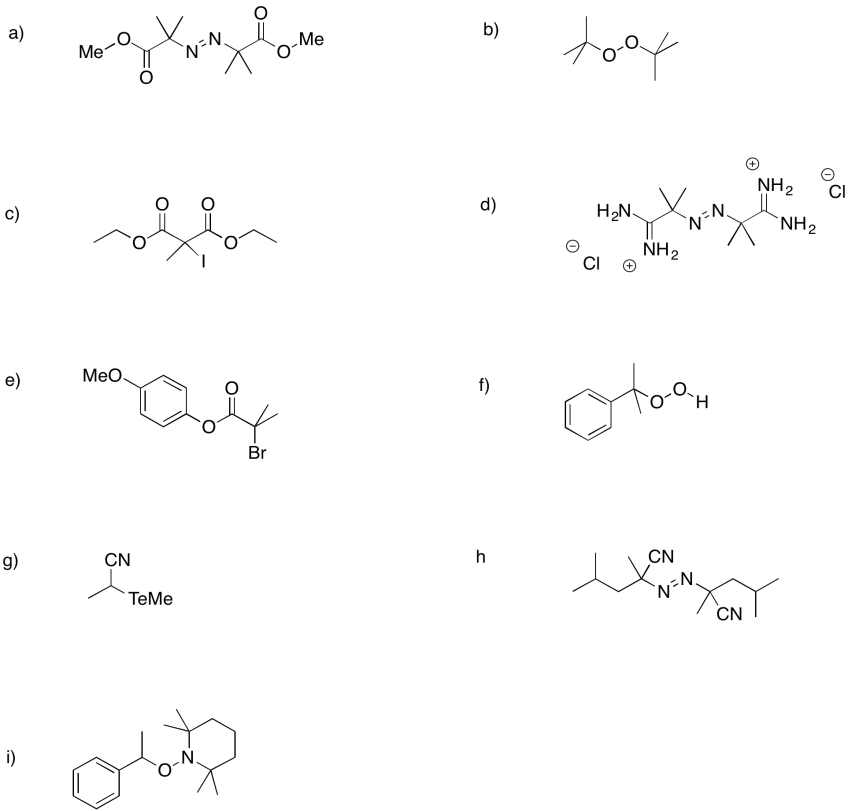
- Contestar
-
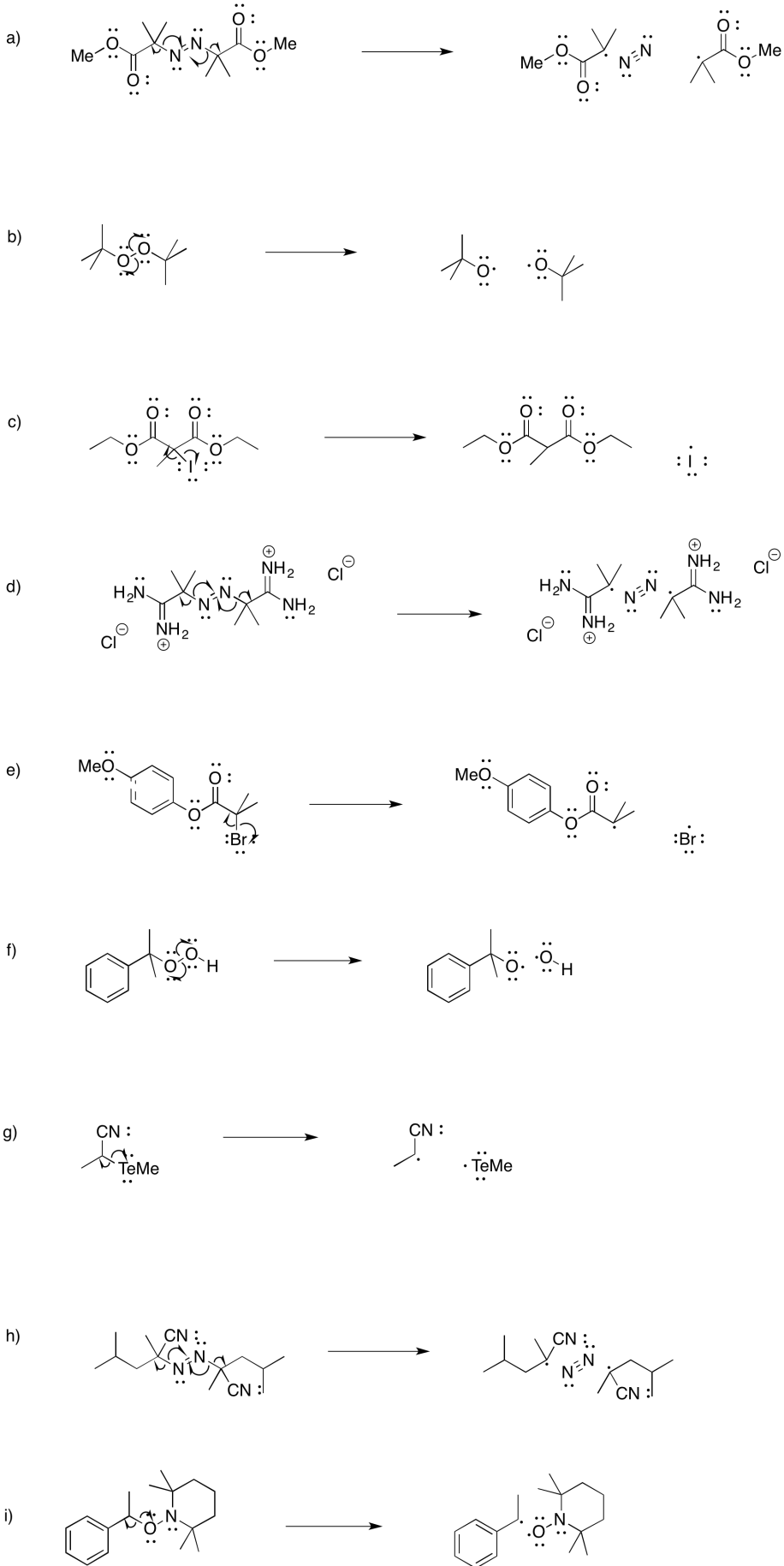
Los químicos tienen una amplia gama de iniciadores disponibles. Los siguientes dos ejemplos son similares en algunos aspectos, pero pueden ser útiles bajo diferentes condiciones. ¿Para qué condiciones sería más adecuado cada iniciador?


