7.7: Soluciones para problemas seleccionados
- Page ID
- 79369
Ejercicio 7.2.1:

Ejercicio 7.2.2:
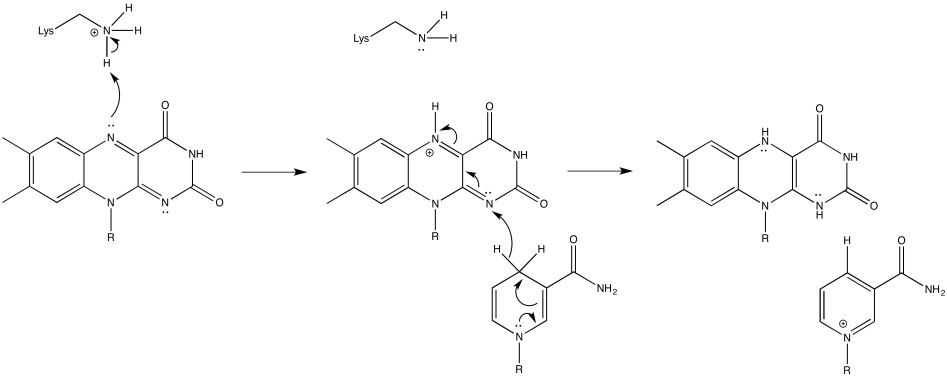
Ejercicio 6.2.3:
a) Cargas de hierro:\(Fe(II) + Fe(III) = 5^{+}\)
Cargas de ligando:\(2 \: sulfides \: = 2 \times 2^{-} = 4^{-} ; 4 \: cysteines \: = 4 \times 1^{-} = 4^{-} ; \: total \:= 8^{-}\)
En general: 3 -
b) Cargos de hierro:\(2 \times Fe(II) + Fe(III) = 4^{+} + 3^{+} = 7^{+}\)
Cargas de ligando:\(4 \: sulfides \: = 4 \times 2^{-} = 8^{-}; 3 \: cysteines \: = 3 \times 1^{-} = 3^{-} ; \: total \: = 11^{-}\)
En general: 4 -
c) Cargas de hierro:\(3 \times Fe(II) + Fe(III) = 6^{+} + 3^{+} = 9^{+}\)
Cargas de ligando:\(4 \: sulfides \: = 4 \times 2^{-} = 8^{-} ; 4 \: cysteines \: = 4 \times 1^{-} = 4^{-} ; \: total \: = 12^{-}\)
En general: 3 -
Ejercicio 7.2.4:
Al reducirse, la carga en un clúster de 2Fe2S aumentará de 3 - a 4 -, asumiendo que inicia en un estado mixto Fe (II)/(III) (mientras que si inicia en un estado Fe (III)/(III), la carga general aumentará de 2 - a 3 -). Estos aniones serían estabilizados por fuertes interacciones intermoleculares tales como fuerzas ión-dipolo. Ambos estados (oxidado y reducido) serán estabilizados por un ambiente polar, pero el estado reducido con mayor carga dependerá aún más fuertemente de la estabilización por parte del medio ambiente. Como resultado, podríamos esperar que el potencial de reducción sea menor cuando esté rodeado de residuos de aminoácidos no polares, y mayor si está rodeado de residuos polares.
Ejercicio 7.2.5:
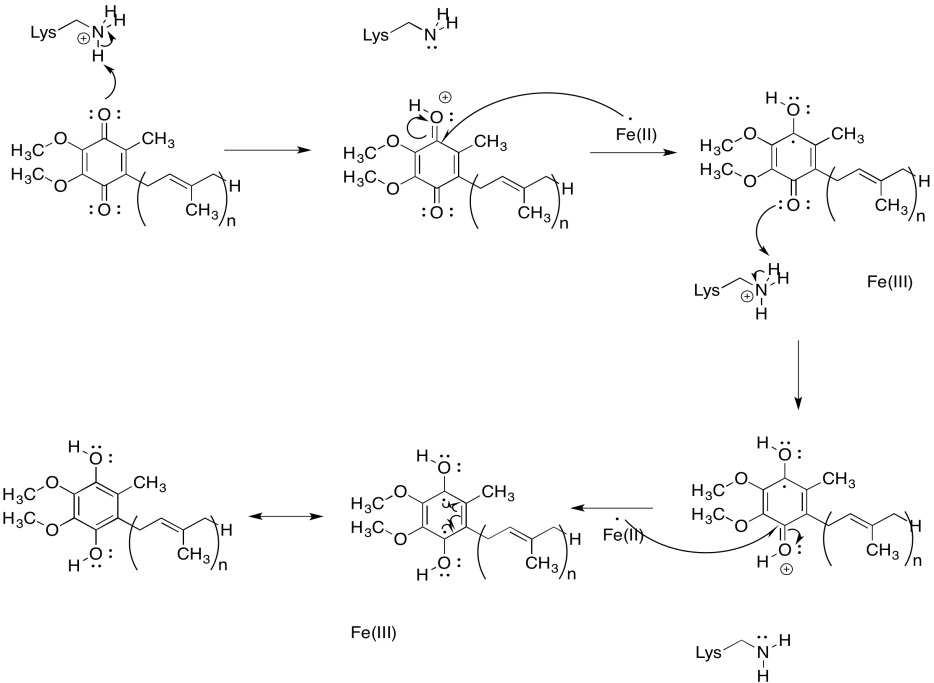
Ejercicio 7.2.6:

Ejercicio 7.2.7:

Ejercicio 7.2.8:
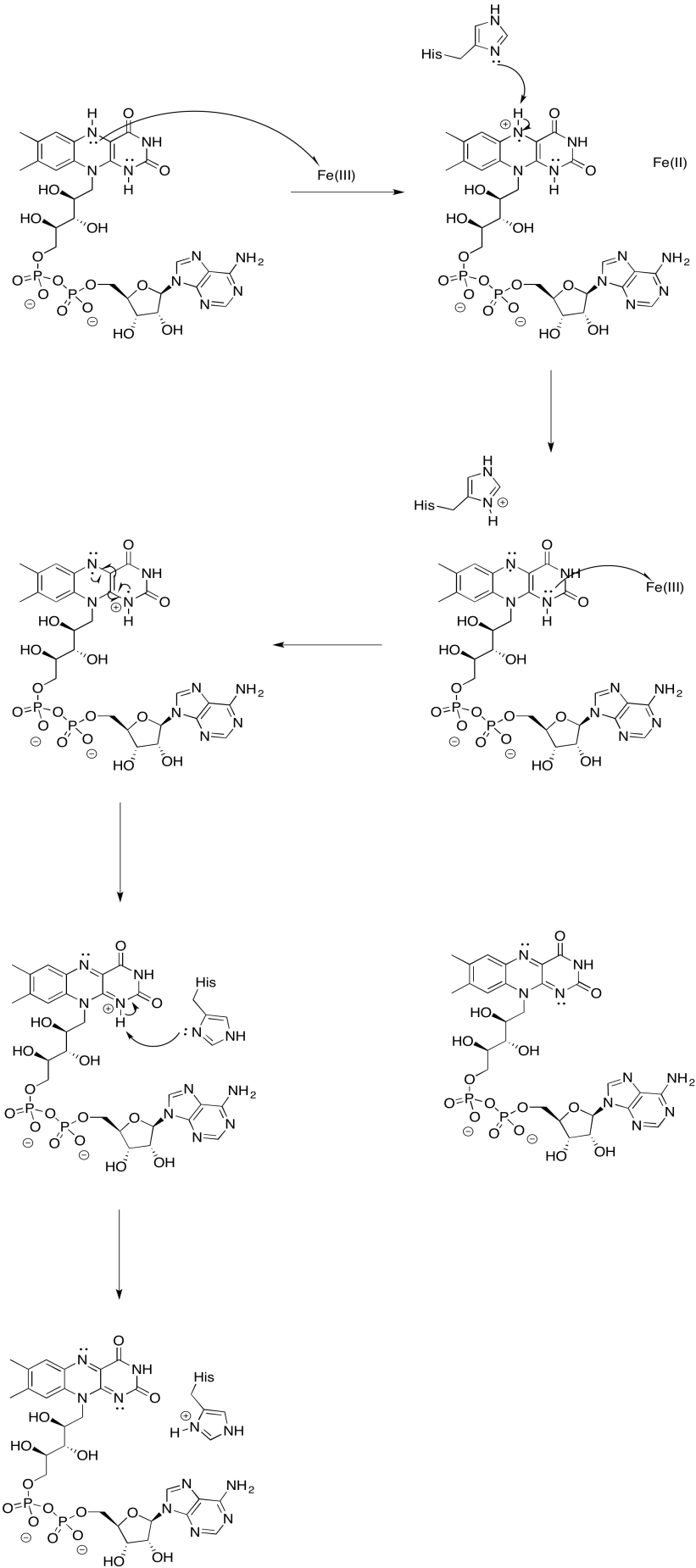
Ejercicio 7.2.9:
a) Lo más probable es que N1a y N1b no estén involucrados, debido a que sus potenciales de reducción son demasiado negativos.
b)
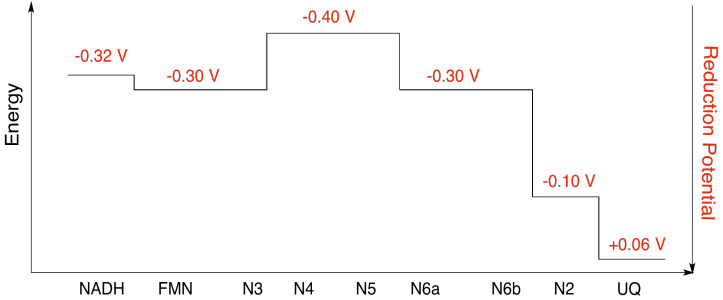
Ejercicio 7.2.10:
Suponiendo que los potenciales de reducción son:
\[N5(ox) + e^{-} \rightarrow N5(red)\) \(E^{o}_{red}= -0.40V \nonumber\]
\[N6a(ox) + e^{-} \rightarrow N6a(red)\) \(E^{o}_{red} = -0.30V \nonumber\]
Entonces la diferencia potencial para la reacción,\(\Delta E^{o} = -0.30 - (-0.40)V = 0.10V\)
La relación Faraday\(\Delta G= -n F \Delta E^{o} \) da
\[\Delta G = -1 \times 96485 \frac{J}{V \: mol} \times 0.10 V = 9649 \frac{J}{mol} = 9.7 \frac{kJ}{mol} \nonumber\]
Ejercicio 7.3.1:
Heme b.
Ejercicio 7.3.2:
Una porfirina contiene cuatro anillos pirrol (anillo aromático de cinco miembros que contiene nitrógeno) dispuestos para formar un macrociclo de 16 miembros.
Ejercicio 7.3.3:
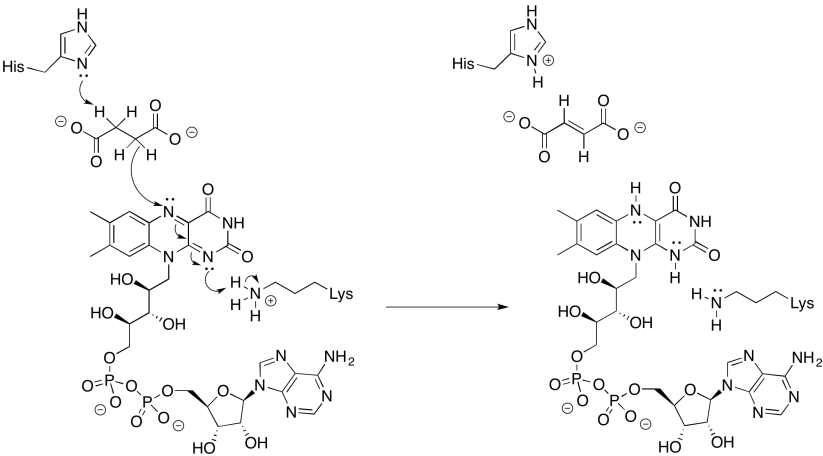
Ejercicio 7.3.4:
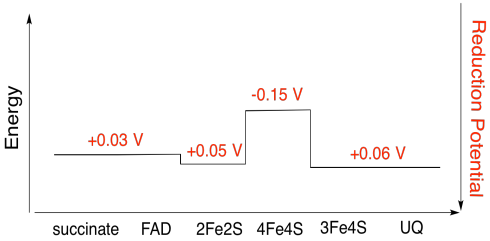
Ejercicio 7.3.5:
Suponiendo que los potenciales de reducción son:
\[4Fe4s(ox) + e^{-} \rightarrow 4Fe4S(red)\) \(E^{o}_{red} = -0.15V \nonumber\]
\[3Fe4S(ox) + e^{-} \rightarrow 3Fe4S(red)\) \(E^{o}_{red} = 0.06V \nonumber\]
Entonces la diferencia potencial para la reacción,\(\Delta E^{o} = 0.06 -(-0.15)V = 0.21V\)
La relación Faraday\(\Delta G = -n F \Dleta E^{o}\) da
\[\Delta G = -1 \times 96485 \frac{J}{V \: mol} \times 0.21 V = 20262 \frac{J}{mol} = 20 \frac{kJ}{mol} \nonumber\]
Ejercicio 7.3.6:
a) Cargas de hierro:\(2 \times Fe(III) = 6^{+}\)
Cargas de ligando:\(2 \: sulfides \: = 2 \times 2^{-}= 4^{-} ; 4 \: cysteines \: = 4 \times 1^{-} = 4^{-} ; \: total \: = 8^{-}\)
En general: 2 -
b) Cargos de hierro:\(3 \times Fe(III) = 9^{+}\)
Cargas de ligando:\(4 \: sulfides \: 4 \times 2^{-} = 8^{-} ; 3 \: cysteines \: = 3 \times 1^{-} = 3^{-} ; \: total \: = 11^{-}\)
En general: 2 -
c) Cargas de hierro:\(4 \times Fe(III) = 12^{+}\)
Cargas de ligando:\(4 \: sulfides = 4 \times 2^{-} = 8^{-} ; 4 \: cysteines \: = 4 \times 1^{-} = 4^{-} ; \: total \: = 12^{-}\)
En general: 0
Ejercicio 7.4.1:
La arninina y la lisina están cargadas positivamente a pH neutro.
Ejercicio 7.4.2:
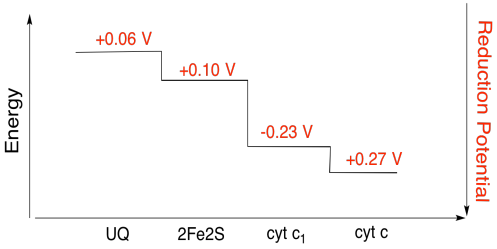
Ejercicio 7.4.3:
Suponiendo que los potenciales de reducción son:
\[2Fe2S(ox) + e^{-} \rightarrow 2Fe2S(red)\) \(E^{o}_{red} = 0.10V \nonumber\]
\[cyt \: c_{1} (ox) + 3^{-} \rightarrow cyt \: c_{1} (red)\) \(E^{o}_{red}= 0.230V \nonumber\]
Entonces la diferencia potencial para la reacción,\(\Delta E^{o} = 0.23- (0.10) V = 0.13V\)
La relación Faraday\(\Delta G = -nF \Delta E^{o}\) da
\[\Delta G = -1 \times 96485 \frac{J}{V \: mol} \times 0.13V = 12543 \frac{J}{mol} = 12.5 \frac{kJ}{mol} \nonumber\]
Ejercicio 7.4.4:
Los residuos de arginina positivos conferirían carga positiva parcial a la ubiquinona a través de enlaces de hidrógeno; la ubiquinona tendría un potencial de reducción más positivo como resultado.
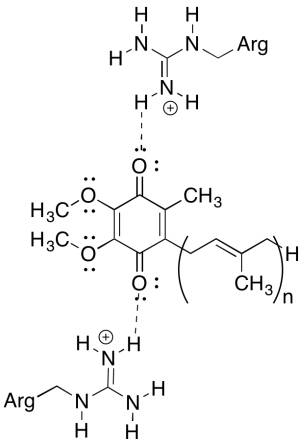
Ejercicio 7.5.1:
\[\ce{O2 -> H2O} \nonumber\]
\(\ce{O2 -> 2H2O}\)(O equilibrado)
\(\ce{O2 + 4H^{+} -> 2H2O}\)(H balanceado)
\(\ce{O2 + 4e^{-} + 4H^{+} -> 2H2O}\)(carga balanceada)
Ejercicio 7.5.2:
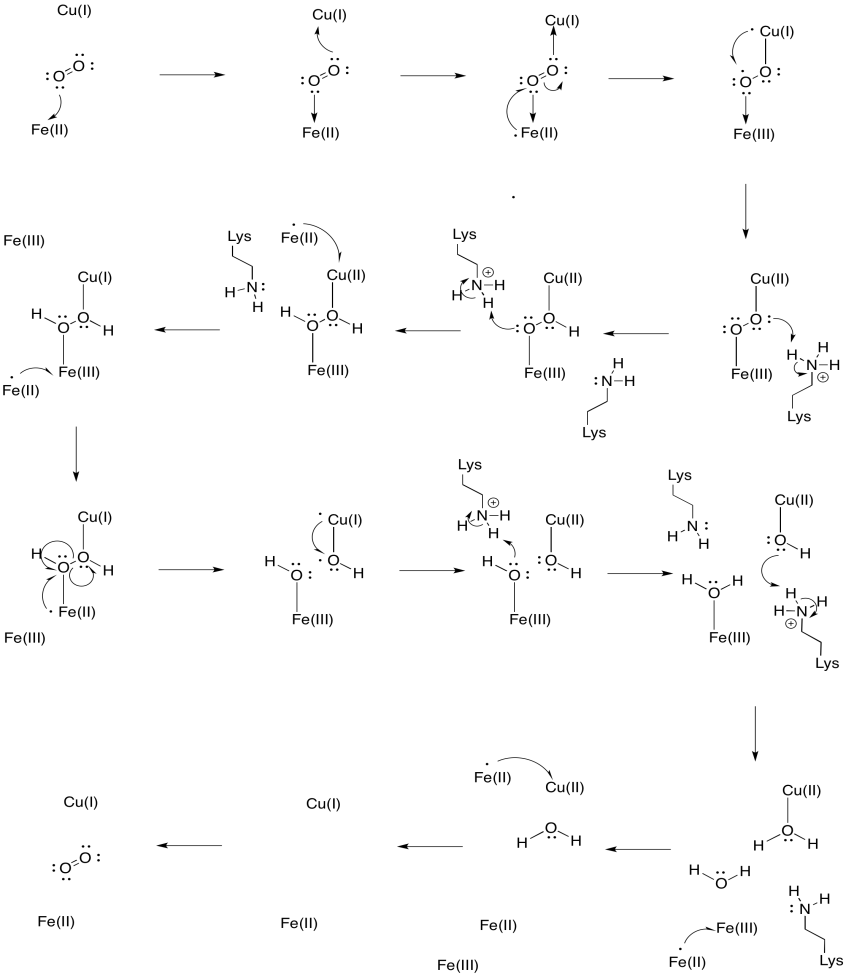
Ejercicio 7.5.3:
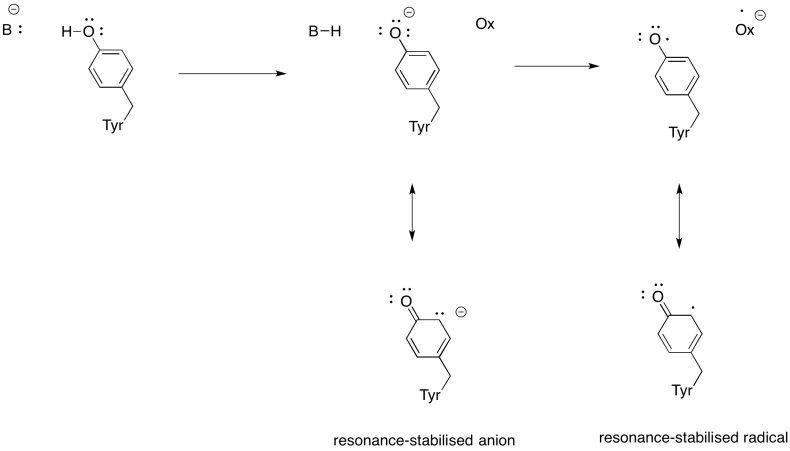
Ejercicio 7.5.4:
a)
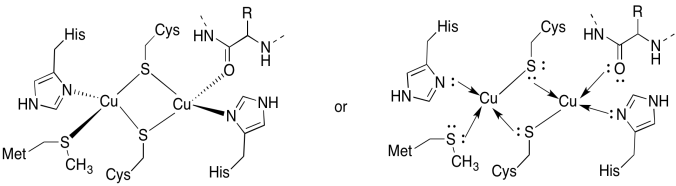
b) tetraédrico
c) Cu (I) = d 10
4 donantes = 8 e -
total = 18e -
d) 2 x Cu (I) = 2 +
2 x Cis-S - = 2 -
Todos los demás neutrales
Total = 0
Ejercicio 7.5.5:
a)
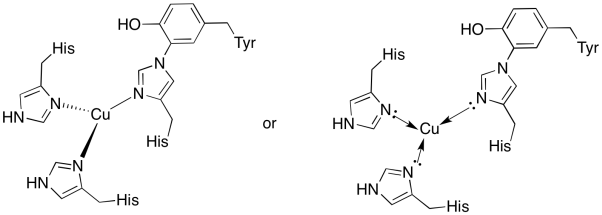
) plano trigonal
c) Cu (I) = d 10
3 donantes = 6 e -
total = 16 e -
d) Cu (I) = 1 +
histidinas neutras
Total = 1 +
Ejercicio 7.5.6:
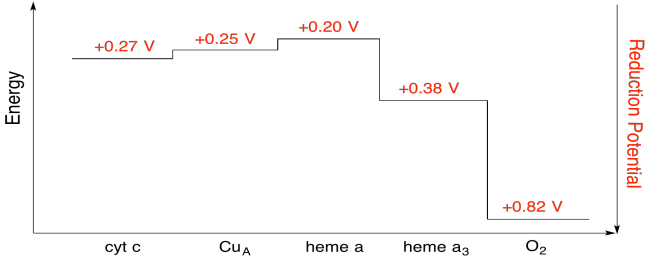
Ejercicio 7.5.7:
Suponiendo que los potenciales de reducción son:
\[heme \: a(ox) + e^{-} \rightarrow heme \: a(red)\) \(E^{o}_{red} = 0.20V \nonumber\]
\[heme \: a_{3}(ox) + e^{-} \rightarrow heme \: a_{3}(red)\) \(E^{o}_{red} = 0.38V \nonumber\]
Entonces la diferencia potencial para la reacción,\(\Delta E^{o} = 0.38 - (0.20)V = 0.18V\)
La relación Faraday\(\Delta G = -n F \Delta E^{o} \) da
\[\Delta G = -1 \times 96485 \frac{J}{V \: mol} \times 0.13V = 17367 \frac{J}{mol} = 17.4 \frac{kJ}{mol} \nonumber\]
Ejercicio 7.6.1:
Estos aminoácidos probablemente serían no polares: alanina, glicina, metionina, isoleucina, leucina, metionina, fenilalanina, triptófano, valina.
Ejercicio 7.6.2:
Siempre hay un equilibrio entre el estado protonado y el estado desprotonado en un residuo de aminoácido cargado. Para esta posición, se necesita un aminoácido que esté más confiablemente en el estado protonado; es decir, el equilibrio se encuentra más fuertemente al lado protonado de la ecuación. Debido al catión estabilizado por resonancia que resulta de la protonación, la arginina es mucho más probable que permanezca en un estado protonado que la lisina. Eso hará que la rueda de molino sea más eficiente.
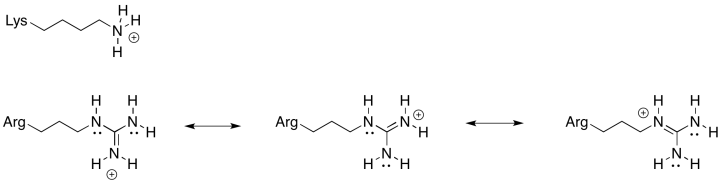
Ejercicio 7.6.3:
El ADP y el fosfato son ambos aniones; se repelerían normalmente entre sí. Cuando se enlazan en el sitio activo, sus cargas son probablemente neutralizadas por cargas complementarias en el sitio activo.
Ejercicio 7.6.4:
Suponiendo que los potenciales de reducción son:
\[\ce{NAD^{+} + 2e^{-} + 2H^{+} -> NADH}\) \(E^{o}_{red} = -0.32V \nonumber\]
\[\ce{0.5 O2 + 2e^{-} + 2H^{+} -> H2O}\) \(E^{o}_{red} = 0.816V \nonumber\]
Entonces la diferencia potencial para la reacción,\(\Delta E^{o} = 0.816 - (-0.32)V = 1.136V\)
La relación Faraday\(\Delta G = -NF \Delta E^{o}\) da
\[\Delta G = -2 \times 96475 \frac {J}{V \: mol} \times 1.136V = 219213 \frac{J}{mol} = 219 \frac{kJ}{mol} \nonumber\]
por lo\(\frac{219 \frac{kJ}{mol}} {30 \frac{kJ}{mol}} = 7.3\)
Con una eficiencia del 100%, se podrían producir 7 moles de ATP por mol de NADH. En realidad, se produce aproximadamente la mitad de esa cantidad (más cerca de 3 moles de ATP por mol de NADH).

