7.6: Complejo V
- Page ID
- 79342
La fosforilación oxidativa es un proceso metabólico en el que se aprovecha la energía para la producción de ATP. Hasta ahora hemos mirado la cadena de transporte de electrones, que es reponsible por el establecimiento de un gradiente de protones a través de la membrana mitocondrial interna. La síntesis real de ATP ocurre en el complejo V.
El complejo V es muy grande y contiene muchas proteínas diferentes. No obstante, aquí simplificaremos la imagen. Esquemáticamente, el Complejo V consiste en un canal protónico que conduce desde el espacio intermembrana hacia la matriz. A medida que los protones regresan a través de la membrana después de haber sido bombeados a lo largo de la cadena de transporte de electrones, provocan la rotación de una rueda de molino a nanoescala Esta muela ayuda a unir el ADP al fosfato, formando ATP.
- La rotación de un rotor molecular en el Complejo V ayuda a unir un ADP y un fosfato para formar ATP.
- La rotación del rotor es impulsada por protones que vuelven a caer a través del Complejo V y hacia la matriz mitocondiral de abajo.
- El espacio intermembrana está dopado con p (exceso de carga positiva) mientras que la matriz mitocondrial está dopada con n (exceso de carga negativa), impulsando el flujo de protones hacia la matriz mitocondrial.
- Por cada tres protones que caen a través del complejo, se forma una molécula de ATP.

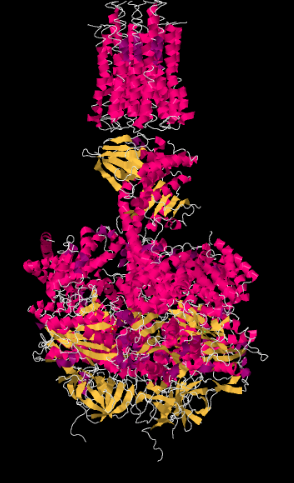
A continuación se muestra una estructura cristalina de rayos X del Complejo V. En la parte superior de la imagen, se puede ver la porción unida a la membrana. Esas hélices α-corren paralelas a las cadenas de ácidos grasos en la capa lipídica, de manera que la proteína encaja perfectamente en la membrana. La parte inferior de la estructura es la porción que se extiende dentro de la matriz.
Ejercicio\(\PageIndex{1}\)
Recordemos que en una hélice α, los residuos de aminoácidos se proyectan hacia afuera alrededor de la hélice. Sugiere algunos residuos que probablemente se encuentren a lo largo de la porción unida a la membrana del complejo.

- Contestar
-
Estos aminoácidos probablemente serían no polares: alanina, glicina, metionina, isoleucina, leucina, metionina, fenilalanina, triptófano, valina.
Mirando la estructura desde abajo —es decir, desde el punto de vista de la matriz— podemos ver la simetría rotacional del Complejo V. El complejo V contiene un rotor molecular que se utiliza en la fabricación de ATP. Este rotor está hecho de un grupo de proteínas que son capaces de moverse más allá de otro grupo de proteínas a medida que los protones pasan por el complejo.
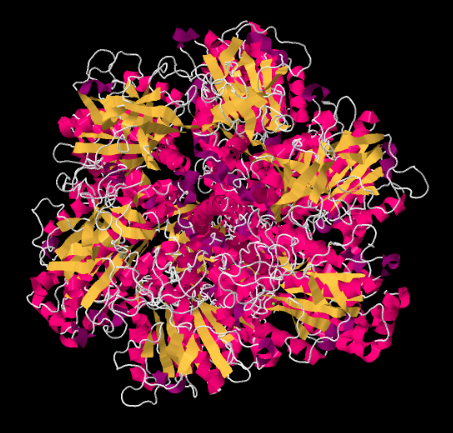
El mecanismo del rotor funciona algo así como un motor eléctrico. El motor molecular contiene dos partes: una parte estacionaria, o estator, y una parte giratoria, o rotor. Las dos partes tienen cargos complementarios. La parte estacionaria tiene un residuo de arginina cargado positivamente. La parte giratoria tiene un residuo de aspartato cargado negativamente. El residuo de aspartato es atraído por el residuo de arginina, lo que provoca que el rotor comience a girar.
- El estator es la parte estacionaria de un motor.
- El rotor es la parte giratoria de un motor.
- Una atracción temporal atrae un sitio en el rotor hacia el estator.
- Cuando esa atracción se apaga, el impulso lleva ese sitio en el rotor más allá del estator.
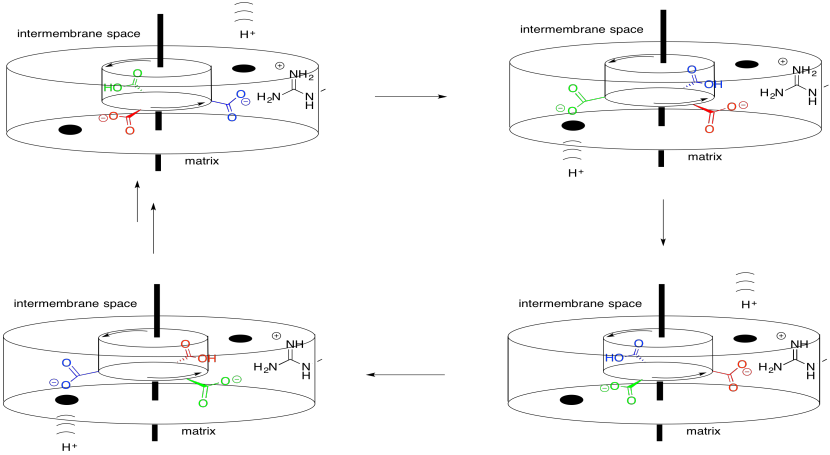
Por supuesto, si esa fuera toda la historia, el aspartato (y el rotor) dejarían de moverse cuando se acercara lo más posible a la arginina. Ese sería el final de la historia. En cambio, un protón llega a medida que se mueve desde el espacio intermembrana hacia la matriz. Se une al aspartato, volviéndolo neutro. Ya no cargado, el aspartato sigue pasando por encima de la arginina.
En tanto, otro residuo de aspartato se encuentra con la continuación del canal protónico que conduce hacia la matriz. Libera su protón, llegando a ser acusado. Luego es atraído por la arginina en el estator, continuando la rotación del rotor.
Ejercicio\(\PageIndex{2}\)
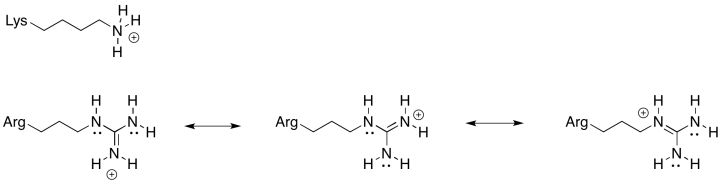
También podría imaginarse un residuo de lisina en el estator en lugar de la arginina que se muestra arriba. ¿Por qué una arginina es un estator positivo más confiable que la lisina?
- Contestar
-
Siempre hay un equilibrio entre el estado protonado y el estado desprotonado en un residuo de aminoácido cargado. Para esta posición, se necesita un aminoácido que esté más confiablemente en el estado protonado; es decir, el equilibrio se encuentra más fuertemente al lado protonado de la ecuación. Debido al catión estabilizado por resonancia que resulta de la protonación, la arginina es mucho más probable que permanezca en un estado protonado que la lisina. Eso hará que la rueda de molino sea más eficiente.
El ADP y el fosfato se unen en la interfaz de dos proteínas a lo largo de este ensamblaje. La rotación aparentemente está involucrada en un mecanismo de aproximación. Durante los cambios conformacionales que resultan de la rotación molecular, el ADP y el fosfato se acercan lo suficiente como para que sean más propensos a unirse entre sí, formando ATP.
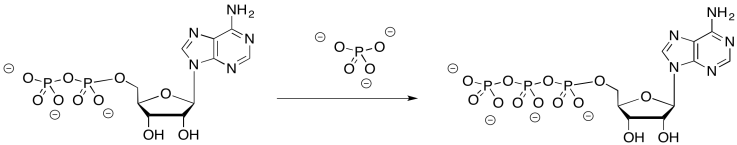
Ejercicio\(\PageIndex{3}\)
¿Por qué podría ser difícil unir ADP y fosfato sin este mecanismo?
- Contestar
-
El ADP y el fosfato son ambos aniones; se repelerían normalmente entre sí. Cuando se unen en el sitio activo, sus cargas son probablemente neutralizadas por cargas complementarias en el sitio activo.
Ejercicio\(\PageIndex{4}\)
La formación de un ATP a partir de ADP cuesta alrededor de 30 kJ/mol. Suponiendo que pudieras capturar toda la energía liberada transfiriendo dos electrones del NADH al O 2, ¿cuántas unidades de ATP podrían hacerse?
- Contestar
-
Suponiendo que los potenciales de reducción son:
NAD + + 2e - + 2 H + → NADH E o rojo = -0.32 V
0.5 O 2 + 2e- + 2 H+ → H 2 O E o rojo = 0.816 V
Entonces la diferencia de potencial para la reacción, ΔE o = 0.816 - (-0.32) V = 1.136 V.
La relación Faraday ΔG = - n F ΔE o da
ΔG = - 2 x 96.485 J V -1 mol -1 x 1.136 V = 219,213 J mol -1 = 219 kJ mol -1
entonces 219 kJ mol -1/30 kJ mol -1 = 7.3
Con una eficiencia del 100%, se podrían producir 7 moles de ATP por mol de NADH. En realidad, se produce aproximadamente la mitad de esa cantidad (más cerca de 3 moles de ATP por mol de NADH).
Consulte la página de enfoque sobre la estructura del Complejo V en Biochemistry Online.
Estructuras de rayos X de: Watt, I.N., Montgomery, M.G., Runswick, M.J., Leslie, A.G.W., Walker, J.E. Costo bioenergético de hacer una molécula de trifosfato de adenosina en mitocondrias animales. Proc.NATL.ACAD.Sci.USA 2010, 107, 16823. Imágenes del Banco de Datos de Proteínas RCSB (2XND).

