8.1: Absorbancia
- Page ID
- 79504
Pensemos primero en la interacción de la luz con la materia.
Todos hemos visto brillar la luz en diferentes objetos. Algunos objetos son brillantes y otros son mate u opacos. Algunos objetos son de diferentes colores. La luz interactúa con estos objetos de diferentes maneras. A veces, la luz pasa directamente a través de un objeto, como una ventana o un trozo de vidrio.
Debido a que las reacciones químicas se realizan frecuentemente en solución, pensaremos en que la luz entra en una solución.
Imagina la luz del sol brillando a través de un vaso de A lo mejor es naranja o refresco de uva; definitivamente está coloreado. Podemos ver que a medida que la luz del sol brilla a través del cristal, la luz de colores sale por el otro lado. Además, sale menos luz que la que entra.
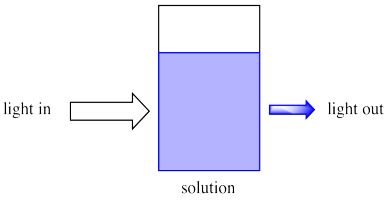
A lo mejor parte de la luz simplemente rebota en el cristal, pero parte de ella definitivamente es absorbida por el refresco.
Entonces, ¿de qué está hecho el refresco? Moléculas. Algunas de estas moléculas son las principales responsables del color de la soda. Hay otros, como los responsables del sabor o la efervescencia de la bebida, así como las moléculas de agua viejas y simples. El refresco es una solución; tiene muchas moléculas (el soluto) disueltas en un disolvente (el agua).
La luz está compuesta por fotones. A medida que los fotones brillan a través de la solución, algunas de las moléculas atrapan los fotones. Absorben la luz. Generalmente, algo en la molécula cambia como resultado. La molécula absorbe energía del fotón y se deja en un estado excitado.
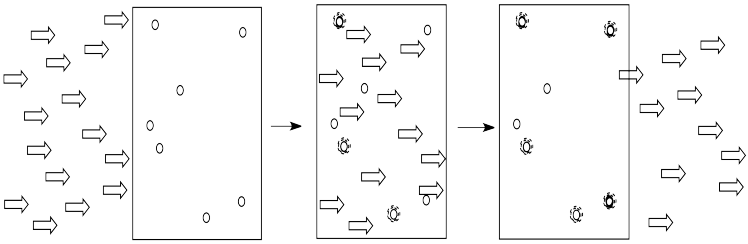
Cuantas más moléculas haya en la solución, más fotones serán absorbidos. Si hay el doble de moléculas en el camino de la luz, se absorberán el doble de fotones. Si doblamos la concentración, doblamos la absorbancia.

- La cantidad de luz absorbida depende de la concentración de la solución.
Alternativamente, si mantuviéramos igual la concentración de moléculas, pero duplicamos la longitud del vaso por el que viajaba la luz, tendría el mismo efecto que duplicar la concentración. Se absorbería el doble de luz.
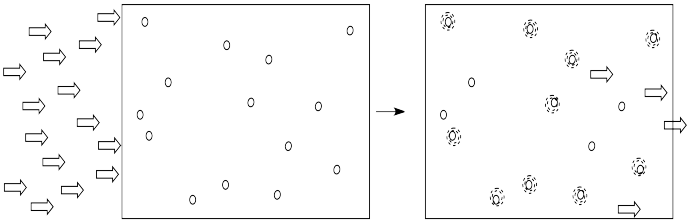
- La absorbancia depende de la longitud de la celda que contiene la solución.
Estos dos factores juntos forman parte de una relación matemática, llamada Ley de Cerveza, que describe la absorción de luz por un material:
\[A = \varepsilon c l \nonumber\]
en el que A = Absorbancia, el porcentaje de luz absorbida; c = la concentración; l = la longitud de la trayectoria de la luz a través de la solución; ε = la “absortividad” o “coeficiente de extinción” del material, que es una medida de la facilidad con la que absorbe un fotón que encuentra.
Ese último factor, ε, sugiere que no todos los fotones se absorben fácilmente, o que no todos los materiales son capaces de absorber fotones igualmente bien. Hay un par de razones para estas diferencias.
Ejercicio\(\PageIndex{1}\)
Calcular la absorbancia en los siguientes casos.
- Una muestra con una absortividad molar ε = 60 L mol -1 cm -1 se diluye a una solución de 0.01 mol L -1 en agua y se coloca en una celda de 1 cm.
- Una muestra con una absortividad molar ε = 3,000 L mol -1 cm -1 se diluye a una solución de 3.5 x 10 -5 mol L -1 en agua y se coloca en una celda de 1 cm.
- Una muestra con una absortividad molar ε = 1.4 L mol -1 cm -1 se diluye a una solución de 0.25 mol L -1 en agua y se coloca en una celda de 0.5 cm.
- Una muestra con una absortividad molar ε = 23,000 L mol -1 cm -1 se diluye a una solución 2.5 x 10 -6 mol L -1 en agua y se coloca en una celda de 1 cm.
- Una muestra con una absortividad molar ε = 14,000 L mol -1 cm -1 se diluye a una solución de 0.015 mmol L -1 en agua y se coloca en una celda de 1 cm.
- Contestar a
-
a) A = ε c l = 60 L mol -1 cm -1 x 0.01 mol L -1 x 1 cm = 0.60 = 60%
- Respuesta b
-
b) A = ε c l = 3,000 L mol -1 cm -1 x 3.5 x 10 -5 mol L -1 x 1 cm = 0.105 = 10.5%
- Respuesta c
-
c) A = ε c l = 1.4 L mol -1 cm -1 x 0.25 mol L -1 x 0.5 cm = 0.175 = 17.5%
- Respuesta d
-
d) A = ε c l = 23,000 L mol -1 cm -1 x 2.5 x 10 -6 mol L -1 x 1 cm = 0.0575 = 5.75%
- Respuesta e
-
e) A = ε c l = 14,000 L mol -1 cm -1 x 0.015 mmol L -1 x 1 cm = 14,000 L mol -1 cm -1 x 0.015 x 10 -3 mol L -1 x 1 cm = 0.21 = 21%
Ejercicio\(\PageIndex{2}\)
Calcular el coeficiente de extinción en los siguientes casos.
- Se observa 30% de absorbancia con una solución de 0.01 mol L -1 en una celda de 1 cm.
- Se observa 25% de absorbancia con una solución de 0.025 mol L -1 en una celda de 1 cm.
- Se observa 95% de absorbancia con una solución de 0.00175 mol L -1 en una celda de 0.5 cm.
- Se observa 66% de absorbancia con una solución de 0.025 mmol L -1 en una celda de 1 cm.
- Contestar a
-
a) ε = A /c l = 0.30/(0.01 mol L -1 x 1 cm) = 30 L mol -1 cm -1
- Respuesta b
-
b) ε = A /c l = 0.25/(0.025 mol L -1 x 1 cm) = 10 L mol -1 cm -1
- Respuesta c
-
c) ε = A /c l = 0.30/(0.01 mol L -1 x 1 cm) = 543 L mol -1 cm -1
- Respuesta d
-
d) ε = A /c l = 0.66/(0.025 m mol L -1 x 1 cm) = 0.66/(0.025 x 10 -3 mol L -1 x 1 cm) = 26.400 L mol -1 cm -1
A menudo, un refresco en particular absorberá luz de un color particular. Es decir, sólo ciertos fotones correspondientes a un color particular de luz son absorbidos por esa soda en particular.
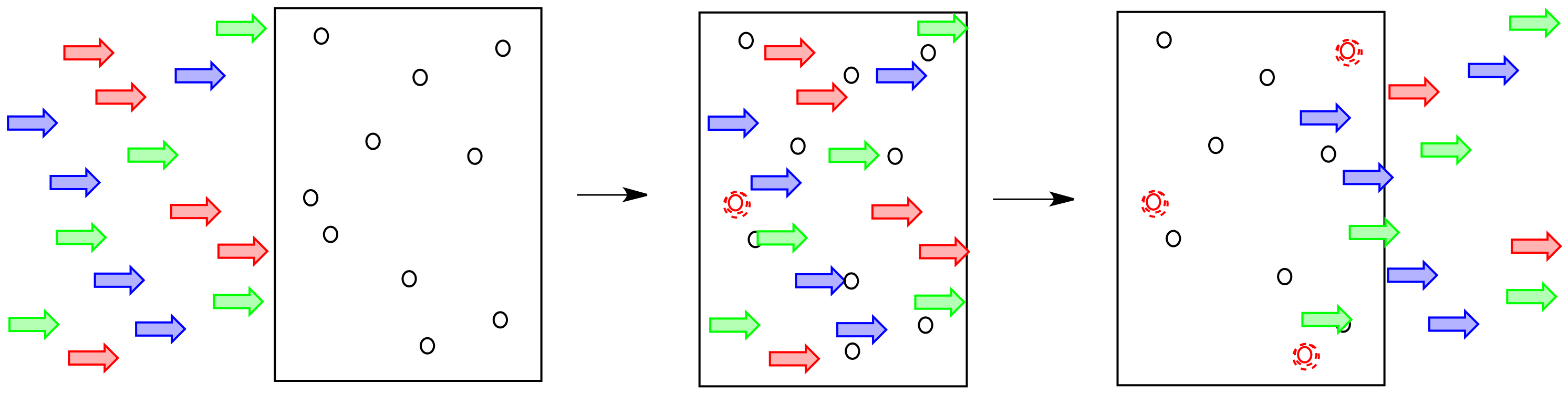
¿Cómo afecta eso a lo que vemos? Si la luz roja está siendo absorbida por el material, no vuelve a salir. La luz azul y amarilla siguen siendo, sin embargo. Eso significa que la luz que sale es menos roja, y más amarillo-azul. Vemos luz verde emergiendo del cristal.
Una “rueda de colores” o “estrella de color” puede ayudarnos a hacer un seguimiento de la idea de colores complementarios. Cuando se absorbe un color en un lado de la estrella, vemos principalmente el color en el lado opuesto de la estrella.
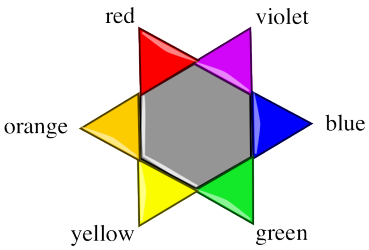
Ejercicio\(\PageIndex{3}\)
- ¿Qué color de fotón es probablemente absorbido más fuertemente por un vaso de soda de naranja?
- ¿Qué color de fotón es absorbido más fuertemente por un vaso de soda de cal?
- ¿Qué color de fotón es absorbido más fuertemente por un vaso de kool-aid de frambuesa azul?
- ¿Qué color de fotón es absorbido más fuertemente por un vaso de refresco de piña?
- ¿Qué color de fotón es absorbido más fuertemente por un vaso de soda de cereza?
- Contestar a
-
a) azul
- Respuesta b
-
b) rojo
- Respuesta c
-
c) naranja
- Respuesta d
-
d) Violeta
- Respuesta e
-
e) verde
¿Por qué ciertos materiales absorben solo ciertos colores de luz? Eso tiene que ver con las propiedades de los fotones. Los fotones tienen dualidad de onda de partículas, al igual que los electrones. Tienen propiedades de onda, incluyendo una longitud de onda.
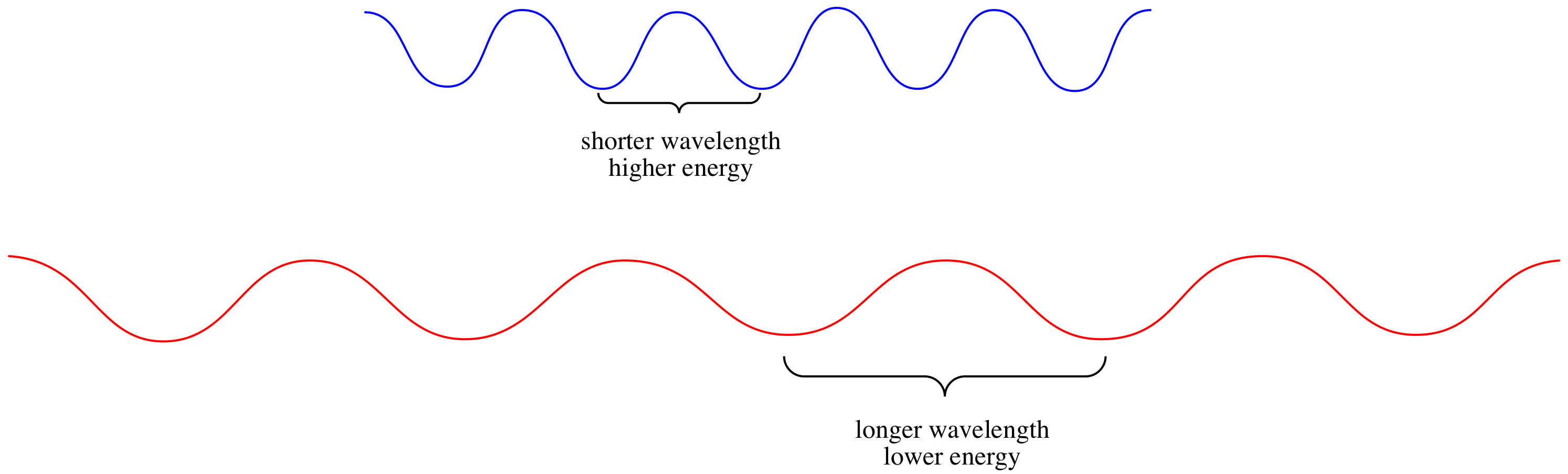
Esa longitud de onda corresponde a la energía de un fotón, según la ecuación de Planck-Einstein:
\[E = \frac{hc}{\lambda} \nonumber\]
en el que E = energía del fotón, h = constante de Planck (6.625 x 10 -34 J s -1), c = velocidad de la luz (3.0 x 10 8 m s -1), λ = longitud de onda de la luz en m.
Alternativamente, la ecuación de Planck-Einstien puede pensarse en términos de frecuencia del fotón: a medida que un fotón pasa a través de un objeto, ¿con qué frecuencia una de sus “crestas” o “abrevaderos” se encuentra con el objeto? ¿Con qué frecuencia una longitud de onda completa del fotón pasa a un objeto? Ese parámetro es inversamente proporcional a la longitud de onda. La ecuación se convierte en:
\[E = H \nu \nonumber\]
en el que ν = la frecuencia del fotón, en s -1.
Ejercicio\(\PageIndex{4}\)
- Calcular la energía de un fotón con una longitud de onda de 1 x 10 -5 m.
- Calcular la energía de un fotón con una longitud de onda de 125 nm.
- Calcular la energía de un fotón con una longitud de onda de 1025 nm.
- Calcular la energía de un fotón con una longitud de onda de 450 µm.
- Calcular la energía de un fotón con una longitud de onda de 850 Å.
- Contestar a
-
a) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /1 x 10 -5 m = 1.98 x 10 -20 J
- Respuesta b
-
b) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /125 x 10 -9 m = 1.59 x 10 -18 J
- Respuesta c
-
c) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /1025 x 10 -9 m = 1.94 x 10 -19 J
- Respuesta d
-
d) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /450 x 10 -6 m = 4.42 x 10 -22 J
- Respuesta e
-
e) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /850 x 10 —10 m = 2.3 x 10-18 J
Ejercicio\(\PageIndex{5}\)
- Calcular la longitud de onda de un fotón de 1.36 x 10 -17 J.
- Calcula la longitud de onda de un fotón de 4.72 x 10 -24 J.
- Calcular la longitud de onda de un fotón de 9.26 x 10 -7 J.
- Contestar a
-
a) λ = h C/e = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /1.46 x 10 —17 J = 1.36 x 10 -8 m
- Respuesta b
-
b) λ = h C/e = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /4.72 x 10 —24 J = 4.21 x 10 -2 m
- Respuesta c
-
c) λ = h C/e = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /9.26 x 10 —17 J = 2.15 x 10 -19 m
Ejercicio\(\PageIndex{6}\)
- Calcular la longitud de onda de un fotón con una frecuencia de 6.7 x 10 10 s -1.
- Calcular la longitud de onda de un fotón con una frecuencia de 1500 MHz.
- Calcular la frecuencia de un fotón con una longitud de onda de 9.8 x 10 -10 m.
- Calcular la frecuencia de un fotón con una longitud de onda de 4.3 x 10 -12 m.
- Contestar a
-
a) E = h ν = h c/λ; entonces ν = c/λ; o λ = c/ν = 3.0 x 10 8 m s -1 /6.7 x 10 10 s -1 = 4.48 x 10 -3 m
- Respuesta b
-
b) λ = c/ν = 3.0 x 10 8 m s -1 /1500 x 10 6 s -1 = 0.2 m
- Respuesta c
-
c) ν = c/λ = 3.0 x 10 8 m s -1 /9.8 x 10 -10 m = 3.06 x 10 15 s -1
- Respuesta d
-
d) ν = c/λ = 3.0 x 10 8 m s -1 /4.3 x 10 -12 m = 7.0 x 10 19 s -1
El espectro visible, que se muestra a continuación, contiene un rango muy limitado de longitudes de onda de fotones, entre aproximadamente 400 y 700 nm.

Cuanto mayor sea la frecuencia, mayor será la energía del fotón. Cuanto más larga es la longitud de onda, menor es la energía del fotón.
Como resultado de esta relación, diferentes fotones tienen diferentes cantidades de energía, debido a que diferentes fotones tienen diferentes longitudes de onda.
Ejercicio\(\PageIndex{7}\)
Diferentes partes del espectro electromagnético interactúan con la materia de diferentes maneras. Debido a eso, podemos usar diferentes longitudes de onda de luz para obtener diferentes tipos de información sobre un material. Calcular la cantidad de energía involucrada en los siguientes tipos de interacciones, en unidades de kJ/mol.
- Rotaciones de enlaces moleculares, medidas por espectroscopía de microondas. Supongamos que el microondas tiene una longitud de onda 1 mm de largo
- Estiramiento y flexión de enlaces, medidos por espectroscopía infrarroja. Supongamos que la longitud de onda IR es 1,000 nm de largo
- Momentos magnéticos nucleares, medidos por ondas de radio en RMN. Supongamos que la onda de radio tiene 1 m de largo.
- La excitación de un electrón de un nivel de energía a otro, medida por espectroscopía ultravioleta y visible. Suponga que la longitud de onda de la luz visible es de 500 nm de largo
- Contestar a
-
a) E = h c/λ
E = (6.625 x 10 -34 J s mol -1 x 3.0 x 10 8 m s -1)/(1 mm x 10 - 3 m mm -1) = 1.99 x 10 -22 J
Eso es por una molécula. Sobre una base por mol, E = 1.99 x 10 -22 J x 6.02 x 10 23 mol -1 = 120 J mol -1 = 0.12 kJ mol -1.
- Respuesta b
-
b) E = h c/λ
E = (6.625 x 10 -34 J s mol -1 x 3.0 x 10 8 m s -1)/(1000 nm x 10 -9 m nm -1) = 1.99 x 10 -19 J
Eso es por una molécula. Sobre una base por mol, E = 1.99 x 10 -19 J x 6.02 x 10 23 mol -1 = 120,000 J mol -1 = 120 kJ mol -1.
- Respuesta c
-
c) E = h c/λ
E = (6.625 x 10 -34 J s mol -1 x 3.0 x 10 8 m s -1)/(1 m) = 1.99 x 10 -25 J
Eso es por una molécula. Sobre una base por mol, E = 1.99 x 10 -25 J x 6.02 x 10 23 mol -1 = 0.120 J mol -1 = 1.2 x 10 -4 kJ mol -1.
- Respuesta d
-
d) E = h c/λ
E = (6.625 x 10 -34 J s mol -1 x 3.0 x 10 8 m s -1)/(500 nm x 10-9 m nm -1) = 3.98 x 10 -19 J
Eso es por una molécula. Sobre una base por mol, E = 3.98 x 10 -19 J x 6.02 x 10 23 mol -1 = 239,000 J mol -1 = 239 kJ mol -1.
Ejercicio\(\PageIndex{8}\)
El espectro visible varía de fotones que tienen longitudes de onda de aproximadamente 400 nm a 700 nm. La primera es la longitud de onda de la luz violeta y la segunda es la longitud de onda de la luz roja. ¿Cuál tiene mayor energía: un fotón de luz azul o un fotón de luz roja?
- Contestar
-
Azul.
Ejercicio\(\PageIndex{9}\)
La luz ultravioleta —invisible para los humanos y con longitudes de onda más allá de la luz violeta— se asocia con daños en la piel; estos son los rayos cancerígenos del sol. Explicar su peligro en términos de su energía relativa.
- Contestar
-
La luz ultravioleta, con una longitud de onda más corta que la luz visible, es mucho mayor en energía y potencialmente más dañina.
Diferentes materiales absorben fotones de diferentes longitudes de onda porque la absorción de un fotón es una absorción de energía. Algo se debe hacer con esa energía. En el caso de la luz ultravioleta y visible, la energía es de la magnitud general correcta para excitar un electrón a un nivel de energía superior.

No obstante, sabemos que la energía está cuantificada. Eso significa que los fotones serán absorbidos solo si tienen exactamente la cantidad correcta de energía para promover un electrón desde su nivel de energía inicial a uno más alto (produciendo un “estado excitado”). Al igual que Ricitos de Oro, un fotón con demasiada energía no va a hacer el truco. Tampoco un fotón con muy poco. Tiene que ser justo.
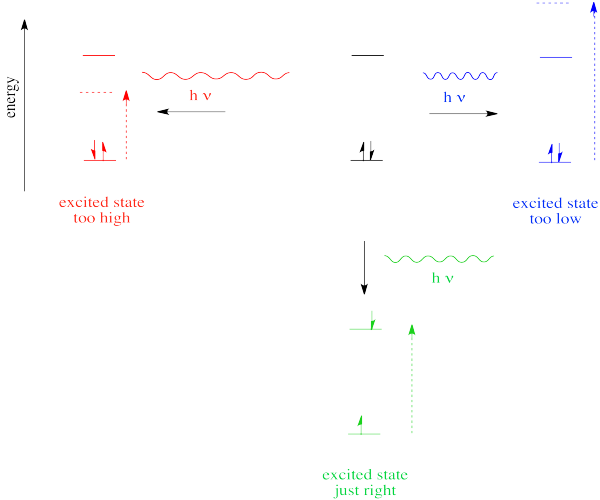
Si la absorción de un fotón UV-visible se acopla a la excitación de un electrón, ¿qué sucede cuando el electrón vuelve a caer al estado fundamental? Se podría esperar que se libere un fotón.
Este fenómeno se observó a finales del siglo XIX, cuando los científicos estudiaron los “espectros de emisión” de los iones metálicos. En estos estudios, los iones metálicos se calentarían en una llama, produciendo colores característicos. En ese caso, el electrón se promovería térmicamente a un nivel de energía superior, y cuando se relajara, se emitiría un fotón correspondiente a la energía de relajación.

Al pasar esta luz a través de un prisma o rejilla, los científicos podrían separar el color observado en líneas separadas de diferentes longitudes de onda. Esta evidencia condujo directamente a la idea de Niels Bohr y otros de que los átomos tenían electrones en diferentes niveles de energía, lo que forma parte de nuestra visión de la estructura electrónica hoy en día.

