8.2: Reglas de Absorbancia
- Page ID
- 79503
Hasta ahora, nos hemos encontrado con una gran regla de absorbancia de fotones. Para ser absorbida, la energía de un fotón tiene que coincidir con una diferencia de energía dentro del compuesto que lo está absorbiendo.
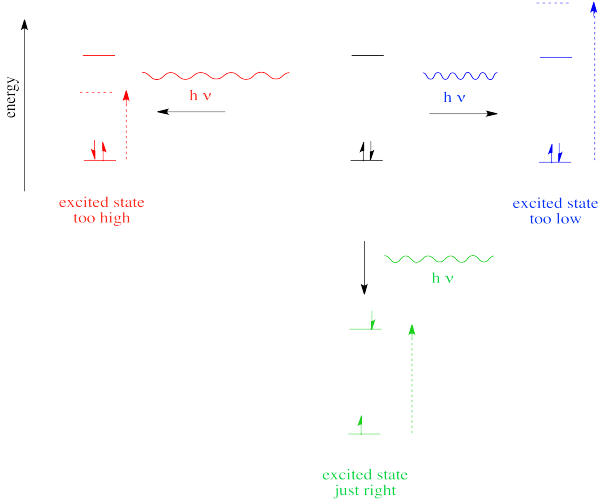
En el caso de la luz visible o ultravioleta, la energía de un fotón se encuentra aproximadamente en la región que sería apropiada para promover un electrón a un nivel de energía superior. Diferentes longitudes de onda serían capaces de promover diferentes electrones, dependiendo de la diferencia de energía entre un nivel de energía electrónica ocupada y uno desocupado.
Otros tipos de radiación electromagnética no serían capaces de promover un electrón, pero estarían acopladas a otros eventos. Por ejemplo, la absorción de la luz infrarroja está ligada a los niveles de energía vibratoria. La radiación de microondas está vinculada a los niveles de energía rotacional en las moléculas.
Así, una razón por la que un fotón puede o no ser absorbido tiene que ver con si su energía corresponde a las diferencias de energía disponibles dentro de la molécula o ion que encuentra.
Franck-Condon: Acoplamiento Electrónico y Vibracional
Los fotones enfrentan otras limitaciones. Una de ellas es una variación moderada de nuestra regla principal. Se llama el Principio Frank Condon. Según esta idea, cuando un electrón se excita desde su posición normal, el estado básico, a un nivel de energía más alto, las posiciones óptimas de los átomos en la molécula pueden necesitar cambiar. Debido a que el movimiento electrónico es mucho más rápido que el movimiento nuclear, sin embargo, cualquier desplazamiento de átomos necesario para optimizar las posiciones como deberían estar en el estado excitado tendrá que esperar hasta después de que el electrón se excita. En ese caso, cuando los electrones aterrizan y los átomos aún no están en sus posiciones de energía más bajas para el estado excitado, la molécula se encontrará en un estado vibracional excitado así como en un estado electrónico excitado.
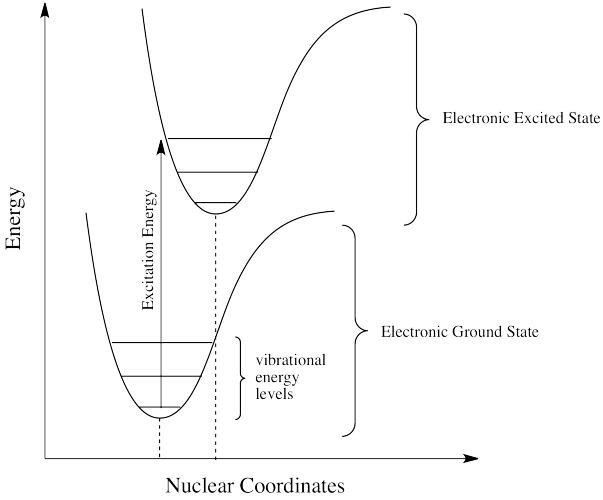
Eso significa que la energía requerida para la excitación no solo corresponde a la diferencia en los niveles de energía electrónica; se afina para alcanzar un nivel de energía vibracional, que también se cuantifica.
- El Principio de Condón Franck establece que las transiciones electrónicas son verticales.
- Una transición vertical es aquella en la que ninguno de los núcleos se mueve mientras el electrón viaja de un estado a otro.
- Una transición vertical puede comenzar en un estado de base vibracional de un estado básico electrónico y terminar en un estado excitado vibracional de un estado excitado electrónico.
LaPorte: Simetría Orbital
Existen otras restricciones sobre la excitación electrónica. Las reglas de selección de simetría, por ejemplo, establecen que el orbital donante (de donde proviene el electrón) y el orbital aceptor (al que se promueve el electrón) deben tener una simetría diferente. Las razones de esta regla se basan en las matemáticas de la mecánica cuántica.
Lo que constituye la misma simetría vs. diferente simetría es un poco más complicado de lo que vamos a entrar aquí. Brevemente, veamos un “elemento de simetría” y comparemos cómo podrían diferir dos orbitales con respecto a ese elemento.
Si un orbital es centrosimétrico, uno puede imaginar cada punto del orbital reflejándose a través del centro mismo de la órbita hasta un punto del otro lado. Al final de la operación, la órbita aparece sin cambios. Eso significa que el orbital es simétrico con respecto a un centro de inversión..

Si hacemos lo mismo con un orbital sigma antibonding, las cosas salen de manera diferente.

En el dibujo, las ubicaciones de los átomos están etiquetadas A y B, pero la simetría del orbital en sí no depende de eso. Si imaginamos enviar cada punto de esta órbita por el mismo centro hacia el otro lado, llegamos a una imagen que se ve exactamente lo contrario de lo que empezamos con.
Estos dos orbitales tienen una simetría diferente. La simetría permite una transición de uno a otro.
Ejercicio\(\PageIndex{1}\)
Decidir si cada uno de los siguientes orbitales es centrosimétrico.
a) a s orbital b) a p orbital c) a d orbital d) a π orbital e) a π* orbital
Ejercicio\(\PageIndex{2}\)
Decidir si cada una de las siguientes transiciones estaría permitida por simetría.
a) π → π* b) p → π* c) p → σ* d) d → d
Las reglas de selección de simetría son en realidad más como “sugerencias fuertes”. Dependen de la simetría de la molécula permaneciendo estrictamente estática, pero todo tipo de distorsiones ocurren a través de vibraciones moleculares. Sin embargo, estas reglas influyen en la probabilidad de una transición dada. La probabilidad de una transición, de manera similar, influye en el coeficiente de extinción, ε.
| transición | ε, coeficiente de extinción |
| π → π* | 3,000 - 25,000 M -1 cm -1 |
| p → π* | 20 - 150 M -1 cm -1 |
| p → σ* | 100 - 7,000 |
| d → π* (MLCT) | 10,000 - 50,000 M -1 cm -1 |
| d → d | 5 - 400 M -1 cm -1 |
Ejercicio\(\PageIndex{1}\)
Sugerir el tipo de transición que probablemente está ocurriendo en cada caso.
- Un complejo de Ti (III) absorbe a 377 nm con ε = 95 M -1 cm -1.
- Una cetona terpenoide absorbe a 538 nm con ε = 11,500 M -1 cm -1.
- Un compuesto de Ru (II) absorbe a 444 nm con ε = 36,000 M -1 cm -1.
- Responder a
-
a) d → d
- Respuesta b
-
b) π → π*
- Respuesta c
-
c) MLCT
Estado de giro
Echemos un vistazo rápido a una última regla sobre las emisiones electrónicas. Esta regla se refiere al giro del electrón excitado, o más correctamente, al “estado de espín” de la especie excitada. El estado de espín describe el número de electrones desapareados en la molécula o ion.
| número de electrones desapareados | estado de giro |
| 0 | singlete |
| 1 | doblete |
| 2 | triplete |
| 3 | cuarteto |
La regla dice que en una transición electrónica, se debe preservar el estado de espín de la molécula. Eso significa que si no hay electrones desapareados antes de la transición, entonces las especies excitadas tampoco deben tener electrones desapareados. Si hay dos electrones desapareados antes de la transición, el estado excitado también debe tener dos electrones desapareados.

Ese diagrama permitido debería parecerte extraño. Estamos acostumbrados a rellenar electrones con espín emparejado por una buena razón: estamos siguiendo la regla de Hund, que dice que el estado de energía más bajo tiene algún giro desapareado paralelo, no opuesto. De hecho, el estado de la izquierda realmente es más bajo en energía que el estado de la derecha; es solo que los electrones no pueden pasar del estado medio (el estado base) al estado izquierdo fácilmente a través de la absorción de un fotón. Sin embargo, pueden pasar del estado fundamental al estado de la derecha con bastante facilidad a través de la absorción de fotones.
Al estado de la izquierda se le llama estado triplete (la “multipicidad” del estado es el número de giros paralelos más uno). Al estado de la derecha se le llama estado singlete. El estado fundamental es también un estado singlete. En general, tenemos un estado singlete terrestre, un estado singlete excitado y un estado triplete excitado.
Como sucede, debido a que el estado triplete excitado es un poco menor en energía que el estado singlete excitado, el electrón puede eventualmente relajarse en el estado triplete excitado. Puede voltear, sin absorber ni liberar un fotón. Esto incluso se llama cruce intersistema. Se relaciona con los fenómenos de fluorescencia y fosforescencia que veremos a continuación.
Ejercicio\(\PageIndex{4}\)
El isomerismo cis-trans de los enlaces C=N proporciona un camino para una rápida relajación vibratoria a partir de estados excitados. Los compuestos que contienen este enlace no emiten fluorescencia porque son capaces de relajarse de nuevo al estado fundamental transfiriendo energía a estados rotacionales y vibracionales.
a) Ilustrar este tipo de isomería en el ejemplo de abajo a la izquierda.

b) Algunas iminas (arriba a la derecha) son fuertemente fluorescentes. Explique la diferencia.
c) ¿Predeciría que el siguiente compuesto, Compuesto L, absorbería la luz UV-Vis?
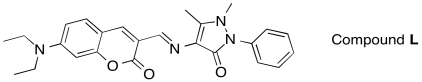
d) ¿Predeciría que el Compuesto L sería fluorescente?
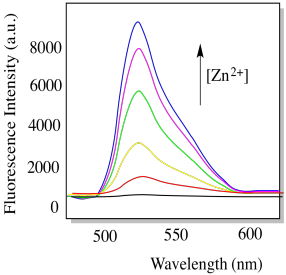
El compuesto L muestra el espectro de absorción a continuación (condiciones: [L] = 10 -6 M; longitud celular = 1 cm).
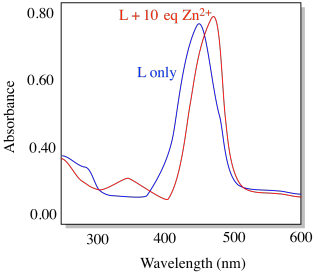
e) Cuál es su absortividad molar aproximada a su λ max (ε, M -1 cm -1)
f) ¿Esta transición está permitida o prohibida?
g) Identificar el tipo de transición que probablemente esté involucrada.
h) En presencia de ion zinc, el compuesto L se vuelve fuertemente fluorescente (abajo). Explica por qué con una estructura. (P.-F. Wang, Org. Lett. 2007, 9, 33-36)
i) Proponer una aplicación práctica para el compuesto L.
- Respuesta b
-
b) El de la izquierda puede relajarse canalizando algo de energía hacia la vibración molecular, especialmente su isomerización cis-trans. El de la derecha no puede hacer eso porque su rotación está restringida por la presencia del anillo.
- Respuesta c
-
c) ¡Por supuesto! Está plagada de enlaces pi. Parece probable una fuerte transición pi-pi* en la región visible.
- Respuesta d
-
d) Probablemente no. No tiene rotación restringida, por lo que la ruta de isomerización cis-trans está disponible para la relajación.
- Respuesta e
-
e) A = ε b c, así ε = A/b c = 0.77/(1 cm x 10 -6 M) = 7.7 x 10 5 M -1 cm -1
- Respuesta f
-
f) Esa es una gran constante de absortividad molar. Está permitido.
- Respuesta g
-
g) Sin duda esta es esa transición pi-pi* en la que estábamos pensando antes.
- Respuesta h
-
h) Si el compuesto se une al zinc, probablemente lo haga a través de la coordinación bidentada. El anillo resultante restringe los grados de libertad en el compuesto por lo que no puede someterse a isomerización cis-trans, cerrando una ruta hacia una rápida relajación.
- Respuesta i
-
i) Un compuesto como este podría ser utilizado para detectar iones metálicos como Zn 2+. Debido a que la cantidad de fluorescencia depende fuertemente de la concentración de Zn 2+, podría usarse para medir la cantidad del ion presente.
Ejercicio\(\PageIndex{5}\)
La transferencia de electrones entre iones metálicos es un evento crucial en una serie de procesos bioquímicos, como la fosforilación oxidativa y la fotosíntesis. Se piensa que los residuos de aminoácidos pueden ayudar a conducir electrones a lo largo de las largas distancias entre los metales.
Harry Gray y sus compañeros de trabajo han realizado estudios de transferencia de electrones en proteínas de cobre azul (azurina) (J. Am. Chem. Soc. 2013, 135, 15515-15525). En el estudio, la proteína se etiqueta primero con [(dmp) Re (CO) 3] +, que se une a un residuo de histidina.
- Dibujar el complejo Re unido a histidina. Forma el isómero fac. Asegúrate de dibujar las estructuras del ligando.
- Este complejo es naranja. ¿Qué color absorbe?
- Si quisieras usar un láser para poner el complejo en un estado excitado, ¿qué longitud de onda elegirías?
- Cuando se pulsa con un láser, el compuesto se somete a transferencia de carga de metal a ligando (MLCT).
i) Dibujar el diagrama de división orbital d para este complejo en el estado fundamental.
ii) Agregue a su diagrama un ligando orbital para MLCT a un nivel de energía apropiado. Etiquetarlo (σ, π, n etc).
iii) Mostrar el diagrama orbital correspondiente para el estado excitado.
iv) El complejo ahora contiene un “agujero” (donde solía estar un electrón). Encierra en un círculo.
e) El complejo experimenta cruce intersistémico al estado triplete dentro de un picosegundo (10 -12 s). Mostrar este cambio.
La transferencia de electrones se produce involucrando el sitio Cu (I)/(II) (E 0 = 0.3 V) y el complejo Re (E 0 = 1.4 V). Esta reacción ocurre dentro de varios nanosegundos (10-9 s).
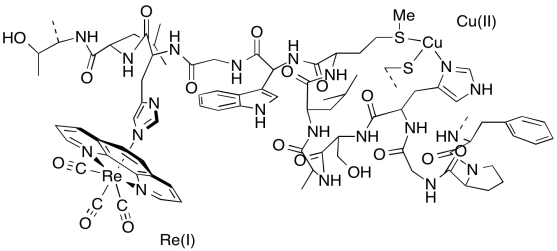
f) Una porción de la estructura cristalina de rayos X de la forma Cu (II) de la proteína se muestra arriba; se supone que la estructura es similar cuando Cu (I) está presente. Dibuja una flecha que muestre la dirección de la transferencia de electrones en la estructura.
g) Esta reacción ET es convenientemente monitoreada por espectroscopía IR, observando los ligandos carbonilo en el complejo Re.
i) ¿En qué región del espectro IR observaría estos ligandos?
ii) Cuando ocurre la transferencia de electrones, ¿la frecuencia IR se desplazaría a cm -1 superior o a cm -1 inferior? Explique por qué.
iii) La distancia Cu-Re es de aproximadamente 20 Angstroms. ¿La transferencia de electrones probablemente ocurre a través de un mecanismo de esfera externa o uno de esfera interna?
h) En estudios de mutagénesis dirigida, no se produjo transferencia de electrones en un mutante W122F; es decir, con W122 (E 0 = 1.37 V) reemplazado por F (E 0 = 1.6 V). Dibujar un mecanismo para la transferencia de electrones en la proteína nativa etiquetada que incorpore esta información.
i) El potencial de reducción del sitio de cobre azul (II/I) varía entre las diferentes formas de la proteína, desde aproximadamente 200 mV hasta 1000 mV. Se ha sugerido que este valor está influenciado principalmente por residuos de aminoácidos más allá de la esfera de coordinación. Dibujar dos residuos de aminoácidos que disminuirían el potencial de reducción, y exponer brevemente cómo lo harían.
Epílogo: En el experimento Re, el electrón finalmente regresa a donde vino, pero no hasta que hayan pasado varios microsegundos (10 -6 s).
- Respuesta b
-
b) Un complejo naranja absorbería la luz azul, su color complementario.
- Respuesta c
-
c) Un láser azul funcionaría. Tal vez en algún lugar alrededor de 476 nm.
- Respuesta d
-
d) Observe los resultados de un sitio Re (II), porque ha transferido un electrón al ligando.
- Respuesta f
-
f) Los potenciales de reducción (1.4 V > 0.3 V) sugieren transferencia del cobre (I) al renio (II).
- Respuesta g
-
g) i) Los tramos de carbonilo se observarían en algún lugar alrededor de 2000 cm -1.
ii) La transferencia de electrones del sitio Cu (I) al Re (II) resultaría en un sitio Re (I). El tramo de carbonilo se desplazaría a un número de onda más bajo. Esto se debe a que el menor estado de oxidación en el metal da como resultado una mayor unión hacia atrás a los carbonilos aceptores de π.
iii) A esa distancia, parece probable un mecanismo de esfera externa; no está claro cómo algo podría salvar esa distancia, aparte de la propia cadena peptídica, que probablemente carece de conjugación suficiente para conducir electrones.
- Respuesta h
-
h) El triptófano actúa como un escalón entre el cobre y el renio. La fenilalanina, con un mayor potencial de reducción que el renio, no.

