8.5: Fotoquímica Atmosférica- Ozono
- Page ID
- 79492
Hay muchas maneras en que la luz juega un papel importante en el mundo. La vida en la tierra depende en gran medida de la fotosíntesis. La energía del sol se puede cosechar y usar para producir ATP, que luego se puede usar para la síntesis de carbohidratos. La energía que se encuentra en la luz, sin embargo, también puede ser muy dañina. De hecho, la luz ultravioleta haría imposible la vida en la tierra si no fuera por la intercesión de la capa de ozono de alta atmósfera. Al sufrir reacciones que absorben la luz UV, las moléculas involucradas en el ciclo del ozono bloquean que gran parte de la luz solar más dañina llegue a la superficie terrestre.
El ciclo del ozono es una serie de reacciones que involucran alótropos de oxígeno. El oxígeno puede estar presente como átomo de oxígeno, O; como molécula de oxígeno, O 2; o como ozono, O 3. Por supuesto, el dioxígeno, u oxígeno molecular, es con mucho la más común de estas formas, constituyendo alrededor del 20% de nuestra atmósfera.
Ahí es donde vamos a empezar. Hay mucho dioxígeno en nuestra atmósfera, por lo que los fotones del sol se encuentran con estas moléculas con bastante frecuencia. Si los fotones tienen suficiente energía, pueden romper el enlace O-O, formando átomos de oxígeno.
\[\ce{O2 + energy -> 2O} \nonumber\]
Esa reacción de fotólisis (es decir, “rota por la luz”) conduce a una acumulación de átomos de oxígeno en la atmósfera superior. Por supuesto, es probable que estos átomos de oxígeno encuentren moléculas de oxígeno, que son muy abundantes. Cuando lo hacen, pueden sufrir una reacción de formación de enlaces, para producir ozono. Esta reacción es puramente formadora de enlaces, y es exotérmica.
\[\ce{O + O2 -> O3 + energy} \nonumber\]
También hay un par de reacciones que provocan la eliminación del ozono de la atmósfera. El primero es la reacción del ozono con la luz ultravioleta. La energía de la luz solar puede romper el enlace O-O en el ozono, convirtiéndolo de nuevo en átomo de dioxígeno y oxígeno.
\[\ce{O3 + energy -> O + O2} \nonumber\]
Además, a medida que se acumulan ozono y átomo de oxígeno, las colisiones entre estas dos especies se vuelven cada vez más probables. Si eso sucede, una abstracción de átomos de oxígeno es un resultado obvio, en el que dos moléculas de dioxígeno son los productos. Esta reacción implica tanto la rotura de la unión como la formación de uniones, pero la reacción es exotérmica en general.
\[\ce{O3 + O -> 2O2 + energy} \nonumber\]
Observe esas dos reacciones que consumen energía. Uno de ellos ocurre en la fase de creación de ozono y otro en la fase de eliminación de ozono. En conjunto, estas reacciones contribuyen al consumo de luz ultravioleta a medida que pasa a través de la estratosfera, de manera que menos luz ultravioleta llega a la superficie terrestre debajo. Sin embargo, las dos reacciones están en lados opuestos de un ciclo. El consumo de algo de luz solar provoca la formación de ozono, pero el consumo de luz solar también conduce a la destrucción del ozono.
A continuación se ilustra la termodinámica del ciclo del ozono. De nuevo, dos de las reacciones son endotérmicas, mientras que otras dos son endotérmicas.
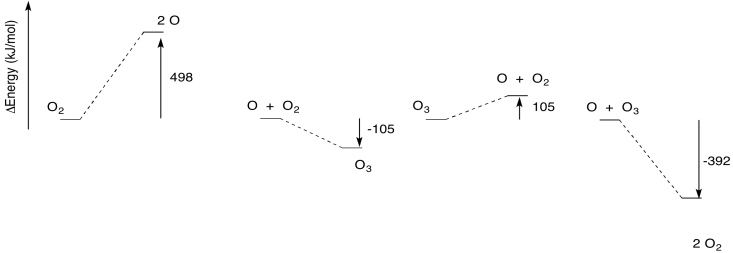
Los pasos endotérmicos en realidad requieren más energía de la que está implícita en la imagen de arriba. Como en cualquier reacción, por lo general no es suficiente suministrar suficiente energía para llegar de un lado de la reacción al otro. También hay una barrera energética que superar. Esa es parte de la razón por la que estas reacciones necesitan luz ultravioleta.
La primera reacción requiere luz de longitudes de onda más cortas que aproximadamente 240 nm.
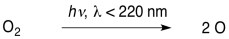
La segunda reacción requiere luz de longitudes de onda más cortas que aproximadamente 325 nm.
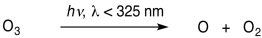
Ejercicio\(\PageIndex{1}\)
¿Por qué hay un límite superior en la longitud de onda de la luz capaz de inducir estas reacciones?
- Contestar
-
Cuanto más larga sea la longitud de onda, menor será la energía. Los fotones de longitud de onda superior a 240 nm no tendrían suficiente energía para superar la barrera para la reacción de escisión de dioxígeno.
Ejercicio\(\PageIndex{2}\)
Calcular la energía, en J, de los siguientes fotones:
- 220 nm
- 325 nm
- Contestar a
-
Según la relación Planck-Einstein:
E = hν
o, ya que ν = c/λ
E = hc/λ
en el que h = Constante de Planck = 6.625 x 10 -34 Js,
c = velocidad de la luz = 3.0 x 10 8 m/s,
ν = frecuencia,
λ = longitud de onda.
a) E = hc/λ
E = (6.525 x 10 -34 Js) (3.0 x 10 8 m/s)/(220 nm) (10 -9 m/nm)
E = 9.03 x 10 -19 J
- Respuesta b
-
b) E = hc/λ
E = (6.525 x 10 -34 Js) (3.0 x 10 8 m/s)/(325 nm) (10 -9 m/nm)
E = 6.12 x 10-19 J
Ejercicio\(\PageIndex{3}\)
- Dada la longitud de onda de luz necesaria para la fotólisis de O 2, calcular la barrera a la reacción, en kJ/mol.
- Esbozar un diagrama de progreso de la reacción para la reacción.
- Contestar a
-
Recuerde, el mol es la unidad de conversión de la escala molecular a la escala macroscópica.
a) E = (8.28 x 10 -19 J/fotón) (6.02 x 10 23 fotones/mol)
E = 543,770 J/mol
E = 544 kJ/mol
- Respuesta b
-
b)

Ejercicio\(\PageIndex{4}\)
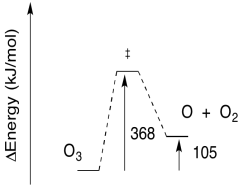
- Dada la longitud de onda de luz necesaria para la fotólisis de O 3, calcular la barrera a la reacción, en kJ/mol.
- Esbozar un diagrama de progreso de la reacción para la reacción.
- Contestar a
-
a) E = (6.12 x 10 -19 J/fotón) (6.02 x 10 23 fotones/mol)
E = 368,146 J/mol
E = 368 kJ/mol
- Respuesta b
-
b)
Ejercicio\(\PageIndex{5}\)
Dado el principio de reversibilidad microscópica, calcular la barrera a las siguientes reacciones, en kJ/mol.
- \(\ce{2O -> O2}\)
- \(\ce{O + O2 -> O3}\)
- Contestar a
-
Las reacciones deben tomar el mismo camino, y sobrepasar la misma barrera, adelante y atrás.
a) La barrera inversa: E = 544 - 498 kJ/mol
E = 46 kJ/mol
- Respuesta b
-
b) La barrera inversa: E = 368 - 105 kJ/mol
E = 263 kJ/mol
El ozono está claramente a una energía más alta que el dioxígeno. El hecho de que existan cantidades apreciables en la atmósfera superior se puede atribuir al aporte constante de energía del sol. Este es un ejemplo de estado estable ambiental. La relación de ozono a oxígeno, aunque todavía bastante baja incluso en la estratosfera, se eleva por encima de su valor de equilibrio natural porque constantemente se agrega energía, empujando al sistema cuesta arriba en energía.
El problema con el cloro
En 1974, Sherwood Rowland, profesor de química en la Universidad de California, Irvine, y Mario Molina, asociado postdoctoral mexicano en su laboratorio, fueron autores de un artículo en la revista Nature que describe cómo los clorofluorocarbonos (CFC) podrían desempeñar un papel en la interferencia con el ciclo del ozono. Los CFC en ese momento eran un compuesto económicamente importante porque eran un refrigerante no tóxico y altamente efectivo utilizado en millones de hogares y negocios en todo el mundo. Rowland y Molina compartieron el Premio Nobel de Química de 1995 con Paul Crutzen, ciudadano holandés que trabajaba en el Instituto Max Planck en Alemania, quien de manera similar reportó los efectos de los óxidos de nitrógeno en el ciclo del ozono.
El problema con los CFC es realmente el hecho de que, en la atmósfera superior, pueden descomponerse para formar átomos de cloro. Por ejemplo, el freón-12, o CF 2 Cl 2, puede absorber la luz ultravioleta, dando como resultado la escisión del enlace C-Cl.
El átomo de cloro en la estratosfera interfiere con el ciclo del ozono al consumir tanto ozono como, indirectamente, un intermedio clave en la formación de ozono, el átomo de oxígeno.
\[\ce{O3 + Cl -> ClO + O2} \nonumber\]
\[\ce{ClO + O -> O2 + Cl} \nonumber\]
Lo que hace que el papel del cloro sea particularmente problemático es que, además de eliminar el ozono y un intermedio necesario para reemplazarlo, el cloro se regenera al final, por lo que es capaz de volver al sistema y hacerlo todo de nuevo. Es destructivo para el ozono, y con eficiencia catalítica.
Después de que se introdujeron regulaciones ambientales que obligaban a una eventual eliminación gradual de los CFC en toda la industria, la industria pudo responder con el desarrollo de sustitutos libres de cloro que aún no eran tóxicos y no inflamables (ambos importantes para uso doméstico). Los hidrofluorocarbonos son el principal tipo de reemplazo que se ha desarrollado para su uso hoy en día. Existen otros compuestos comúnmente utilizados como refrigerantes, pero tienen inconvenientes significativos. El amoníaco es tóxico y los hidrocarburos son muy inflamables.
Existe una consideración adicional que los investigadores deben tener en cuenta al buscar reemplazos de CFC, sin embargo: de por vida. Si una molécula dura demasiado tiempo en la atmósfera, existe el riesgo de una acumulación a largo plazo que puede resultar en consecuencias ambientales adicionales. El hecho de que los clorocarbonos y fluorocarbonos contengan enlaces polares C-Cl y C-F significa que absorberán fuertemente la radiación infrarroja, por lo que actuarán como gases de efecto invernadero. Esa es parte de la razón por la que se utilizan hidrofluorocarbonos. El enlace C-H en un hidrofluorocarbono es fácilmente roto por el radical hidroxi atmosférico, debido a la fuerza del nuevo enlace O-H que se forma. Ese evento proporciona una vía de descomposición que elimina la molécula de la atmósfera más rápidamente.

