8.6: Aplicaciones de la Fotoquímica- Catálisis Fotoredox
- Page ID
- 79491
Hay muchas maneras en que la fotoquímica puede ser aprovechada para hacer cosas útiles. La energía solar es un ejemplo obvio: la luz solar se utiliza para excitar un electrón en un panel solar, lo que lleva a la generación de electricidad. Ese tipo de energía potencialmente puede tener un amplio impacto en otros aspectos de la industria energética. Por ejemplo, varios investigadores han estado tratando de utilizar la luz solar como fuente de energía para producir hidrógeno a partir del agua.
La catálisis fotorredox es la aplicación de la fotoquímica para llevar a cabo reacciones redox catalíticamente. Por ejemplo, si la luz solar fuera absorbida por un material como un semiconductor, dando como resultado la excitación de un electrón, las especies resultantes pueden tener la energía para reducir los protones en el agua a dihidrógeno. Si el semiconductor pudiera regenerarse con un agente reductor, el proceso sería catalítico.
Quizás el aspecto más poderoso de la fotoexcitación es que da como resultado tanto un oxidante potente como un poderoso reductor. La excitación de un electrón resulta en la separación electrón/par hueco. Después de la excitación, el electrón se encuentra en un nivel de energía más alto, y deja atrás un “agujero”, donde solía estar el electrón.
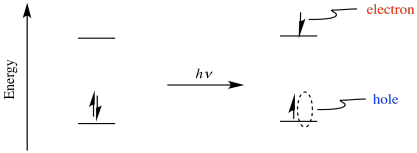
Debido a que el electrón está en un nivel de energía más alto de lo que solía estar, la donación a un aceptor es más favorable de lo que estaba antes. El compuesto se ha convertido en un mejor agente reductor a través de la fotoexcitación. También, debido a que el agujero es menor en energía que el LUMO del estado fundamental, aceptará más fácilmente y electrón de un donante. Eso significa que el compuesto también se ha convertido en un mejor agente oxidante a través de la fotoexcitación.

Podemos estimar cuánto cambia el poder reductor u oxidante de un compuesto al ser excitado por un fotón. Por ejemplo, el potencial de reducción depende del nivel de energía relativa del orbital en el que se donaría un electrón. Tras la fotoexcitación, ese nivel de energía cambia. Va desde el estado fundamental LUMO hasta el nivel del agujero introducido donde solía estar un electrón. La diferencia de energía entre esos dos niveles es la misma que la energía del fotón que se absorbió.
Podemos calcular la energía del fotón absorbido. Esa cantidad viene dada por la relación Planck-Einstein:
\[E = h \nu \: or \: E= \frac{hc}{\lambda} \nonumber\]
en la que E es energía, h es la constante de Planck, ν es la frecuencia del fotón, c es la velocidad de la luz y λ es la longitud de onda del fotón.
Esa energía es la misma que la distancia entre el estado fundamental LUMO y el agujero del estado excitado. Ahora bien, esa es una diferencia de energía a escala cuántica, que se encuentra dentro de una sola molécula. Cuando hablamos de potenciales de reducción, estamos discutiendo un fenómeno macroscópico. Los potenciales de reducción se miden en la escala de la experiencia humana, la escala de lo muy grande, la escala que podemos observar fácilmente. Las mediciones macroscópicas involucran un gran número de átomos, y la unidad conveniente de una gran cantidad de átomos es un mol. Recuerde, ese es solo el factor de conversión entre una cantidad de masa fácilmente medible (un gramo) y una cantidad de masa a escala cuántica (una unidad de masa atómica, también llamada amu o Dalton).
Entonces podríamos pensar en cuánta energía se necesitaría para obtener un mol entero de moléculas en el estado excitado, lo que simplemente requeriría el uso del número de Avogadro. Claramente esta será una cantidad mucho mayor de energía de la que se necesita para excitar una sola molécula, y llegaríamos ahí multiplicando por el número de Avogadro.
\[E = (h \nu ) N_{A} \: or \: E = (\frac{hc}{\lambda})N_{A} \nonumber\]
en el que N A = número de Avogadro.
(También podríamos estar tratando con un átomo individual o algún otro tipo de compuesto en lugar de una molécula, pero el argumento sería el mismo).
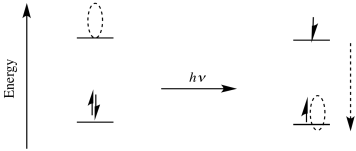
Debido a que el agujero de estado excitado es mucho más bajo en energía que el LUMO original, un electrón que cae en ese agujero liberaría mucha más energía que un electrón que cae en el estado fundamental LUMO. En la escala macroscópica, un mol de electrones cayendo en el agujero del estado excitado liberaría mucha más energía que un mol de electrones que caen en el estado base LUMO; esa diferencia de energía es la cuentidad que acabamos de calcular usando el número de Avogadro.

Por supuesto, un argumento similar se sostiene para el electrón del estado excitado. Es mucho más probable que sea donado a un aceptador después de haber sido excitado por primera vez.

Sabemos que la energía libre liberada cuando un electrón cae a un nivel inferior está relacionada con el potencial de reducción. Esa diferencia viene dada por la relación
\[\Delta G = -nF \Delta E^{o} \nonumber\]
en el que ΔG es el cambio de energía libre, n es el número de electrones transferidos, F es la constante de Faraday, y ΔE o es el potencial de reducción celular, o la diferencia en el potencial de reducción entre el donante y el aceptor.
Aquí haremos una ligera aproximación. La energía del fotón es aproximadamente la diferencia en la energía libre tras la transferencia de electrones de un donante al agujero de estado excitado en comparación con el estado fundamental LUMO (aunque la energía calculada en la relación Planck-Einstein no dice nada sobre la entropía, que es una parte implícita del cambio de energía libre) .
\[E_{excitation} \sim \Delta G_{reduction} \nonumber\]
A partir de ahí, es un paso corto para averiguar el cambio en el potencial de reducción cuando se excita el electrón.
\[\Delta E^{o}_{new} = \Delta E^{o}_{original} + \Delta E^{o}_{photo} \nonumber\]
La posibilidad de una tremenda utilidad de una especie en estado excitado en la catálisis surge del hecho de que el estado excitado puede ser tanto un mejor reductor como un mejor oxidante que la especie en estado fundamental. Como mejor oxidante, puede oxidar fácilmente otro compuesto; como mejor reductor, luego se puede reducir nuevamente, formando la especie original en estado fundamental y completando un ciclo catalítico. Alternativamente, podría actuar primero como reductor y completar el ciclo volviendo a reducirse; el orden de los dos pasos realmente no importa.
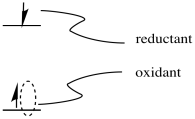
Pensemos en el ejemplo de la producción de hidrógeno. El hidrógeno es muy apelativo como combustible porque, cuando se quema, proporciona una gran cantidad de energía a través de la formación de fuertes enlaces O-H. Además, el producto de su combustión es el agua, que no plantea ningún problema obvio como contaminante. Una economía basada en el consumo de hidrógeno es potencialmente más sustentable en términos ambientales.
¿De dónde podríamos conseguir hidrógeno para impulsar esta economía? Actualmente, obtenemos hidrógeno a partir del carbón y del gas natural. En un proceso llamado reformado con vapor, los gases hidrocarbonados como el metano pueden pasar sobre un catalizador en presencia de vapor, produciendo H 2 y oxigenados de carbono, en su mayoría CO pero también algo de CO 2. Un proceso similar se puede llevar a cabo utilizando carbón en lugar de gas natural. El monóxido de carbono generalmente se captura para otros procesos industriales, pero también se puede usar para producir aún más hidrógeno a través de la reacción de desplazamiento de gas de agua. En la reacción de desplazamiento de gas de agua, el monóxido de carbono se trata nuevamente con vapor sobre un catalizador diferente, produciendo H 2 y dióxido de carbono.
Aunque la reacción de desplazamiento de gas de agua es exotérmica, el reformado con vapor es endotérmico en general, por lo que se debe gastar energía para producir hidrógeno. Esa situación no es óptima, porque terminamos teniendo que gastar mucha energía para producir una fuente de energía. Además, producimos dióxido de carbono, que es un gas de efecto invernadero, cuya producción humana se ha vinculado de manera convincente con el calentamiento global y el cambio climático. Además, las reservas de carbón y gas natural pueden ser abundantes en este momento, pero lo mismo fue también una vez cierto de las reservas de petróleo, y aunque las compañías petroleras continúan localizando y extrayendo nuevos depósitos de petróleo, el proceso de extracción se vuelve más difícil y costoso a medida que estos yacimientos se vuelven más y más remoto o inaccesible.
El agua es la fuente de hidrógeno más abundante en la tierra. Sería mucho más fácil producir hidrógeno a partir del agua. La gente lleva cerca de 200 años haciendo eso, simplemente colocando electrodos en el agua y aplicando un voltaje. Esto se llama electrólisis del agua. El problema es que la electrólisis del agua requiere cantidades masivas de electricidad. La producción de electricidad requiere consumo de energía. En Estados Unidos, la producción de electricidad aún depende en gran medida del consumo de carbón y gas natural, por lo que en lugar de reemplazar nuestra necesidad de estos productos básicos, simplemente los hemos sacado de la vista.
La catálisis fotorredox puede ofrecer una solución. Al producir hidrógeno a partir del agua catalíticamente, tomamos un enfoque de rotonda que requiere menos energía que la electrólisis directa del agua. Al impulsar la reacción fotoquímicamente, podemos aprovechar la luz solar para proporcionar esa energía.
Existen diferentes rutas posibles que pueden convertir protones en dihidrógeno catalíticamente. Un ejemplo ocurre con los compuestos de coordinación. Algunos compuestos de coordinación en estados de baja oxidación pueden protonarse en el centro metálico por el agua. La protonación de un centro metálico es formalmente una adición oxidativa. Una vez que el protón está unido al centro metálico, se considera un ligando hidruro, por lo que ha cambiado formalmente de H + a H -. Los dos electrones para convertirlo en hidruro provinieron del metal.
El recambio catalítico resulta después de que el centro metálico ha sido protonado dos veces, dando como resultado un par de ligandos de hidruro en el metal. La eliminación reductiva del dihidrógeno devuelve dos de los electrones al centro metálico; los otros dos se van con el dihidrógeno. El metal aún necesita dos electrones más de otra fuente, pues al someterse a dos adiciones oxidativas ha donado un total de cuatro electrones a los protones.
Uno de los problemas con este enfoque es que para que el proceso sea catalítico, deben reemplazarse los dos electrones que se enviaron a los protones en el agua para hacer hidrógeno. Muchos investigadores en esta área han utilizado donadores de electrones sacrificiales, compuestos que pueden donar electrones al catalizador para reemplazar los dados a los protones. Los donantes sacrificiales podrían ser cofactores biológicos como ascorbato o succinato, o podrían ser aminas simples.
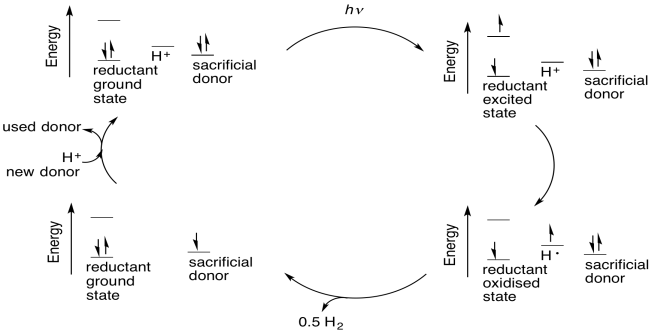
Debido a que estos donantes se consumen en este proceso, representan una ineficiencia potencial en forma de un producto secundario de desecho. Algunos investigadores esperan sortear este problema atando en un ciclo catalítico adicional que regenere a los donantes de electrones. Otros esperan evitar este problema usando el átomo de oxígeno en el agua como donador de sacrificio, produciendo dioxígeno, pero hacerlo con un bajo costo energético es un desafío.
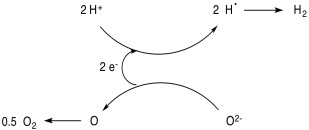
Otro problema es cómo impulsar el sistema fotoquímicamente. Un enfoque común en los esfuerzos de investigación actuales implica el uso de materiales semiconductores que puedan absorber la luz solar (eso es lo que son los paneles solares, después de todo). El electrón de estado excitado se pasa al componente catalítico del sistema, y el orificio es llenado por el donador de electrones sacrificial.
Ejercicio\(\PageIndex{1}\)
Investigadores del estado de Colorado han desarrollado un nuevo sistema para la fotólisis del agua (Finke, ACS Appl. Mater. Interfaces, 2014, ASAP).
El PDI (abajo), un tipo de tinte utilizado en la pintura de automóviles, se recubrió sobre una placa de óxido de indio y estaño. Se obtuvo el espectro UV-Vis y se midió el potencial de reducción.
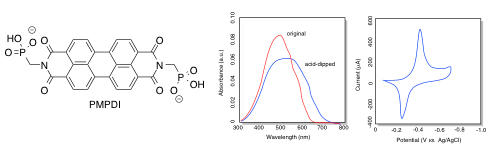
- ¿De qué color es la placa recubierta de PDI original?
- ¿Cuál es la mayor longitud de onda absorbida?
- Traducir esta longitud de onda en energía, en kJ/mol.
- Traducir esta energía en un potencial, en Voltios.
- Mostrar un diagrama de absorbancia de fotones para explicar por qué esta energía es una reflexión más precisa de la banda prohibida en PDI que la de otras longitudes de onda que se absorben.
- ¿Qué tipo de transición probablemente está involucrada, dada la estructura del PDI?
\[MLCT \: d-d \: n \rightarrow \pi * \pi \rightarrow \pi * \nonumber\]
g) ¿Qué sucede con la energía de la transición después de sumergir la placa en ácido?
Se piensa que esta transición puede ser intermolecular en este caso:
\[2 PDI + h \nu \rightarrow PDI + \: PDI- \nonumber\]
h) La mayoría de las moléculas no experimentan excitación fotónica intermolecular. ¿Qué lo hace más fácil en este caso?
i) ¿Cómo es consistente la idea de excitación fotónica intermolecular con el experimento sumergido en ácido?
j) Utilizar el voltamograma cíclico para estimar el potencial de reducción de PDI vs Ag/AgCl.
El óxido de cobalto se fotodepositó sobre la superficie de PDI sumergiendo la placa en solución de nitrato de cobalto (Co (NO 3) 2) tamponada con fosfato (KH 2 PO 4/K 2 HPO 4) e irradiando con una lámpara de arco de xenón.
k) Mostrar un diagrama de división orbital d para el ion cobalto acuoso octaédrico antes y después de la absorción de fotones.
l) Proporcionar un mecanismo para la formación de Co (IV) 2 O en esa solución.
Los siguientes potenciales de reducción han sido reportados en la literatura:
óxido de indio y estaño: -0.10 V vs NHE
óxido de cobalto: 1.23 V vs NHE
agua: 0.83 V vs NHE
Ahora tenemos un problema, porque algunos de nuestros potenciales de reducción se comparan con el NHE; nos dicen lo fácil que es reducir algo en comparación con reducir H +. Algunos se comparan con Ag/AgCl; nos dicen lo fácil que es reducir algo en comparación con reducir Ag +.
m) Si el potencial de reducción de Ag + es +0.20 V vs NHE, entonces ¿cuáles son los siguientes potenciales vs Ag/AgCl?
i) óxido de indio y estaño ii) óxido de cobalto iii) agua
n) Calcular el potencial de reducción del estado excitado PDI*.
o) Rellenar los niveles de energía apropiados para las especies indicadas.
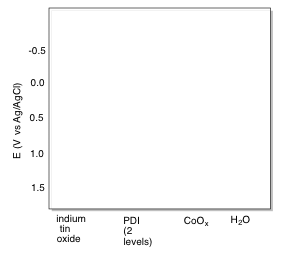
p) Agregar flechas curvas para indicar el flujo de electrones a través del sistema durante la generación de oxígeno fotolítico.
q) Los estudios indican que el sistema no funciona si el PDI no tiene fosfatos adheridos a él. Explique por qué.
- Contestar a
-
a) El PDI original tiene un máximo de absorción a poco menos de 500 nm. Absorbe azul-verde, por lo que se esperaría que apareciera rojo-anaranjado.
- Respuesta b
-
b) La longitud de onda más larga absorbida es aproximadamente 625 nm.
- Respuesta c
-
c) E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /625 x 10 -9 m = 3.18 x 10 -19 J
Esa es la energía de un fotón. Un mol de fotones tendría energía multiplicada por el número de Avogadro, N A.
E = 3.18 x 10 -19 J x NA = 3.18 x 10 -19 x 6.02 x 10 23 mol -1 = 1.91 x 10 5 J mol -1 = 191 kJ mol -1
- Respuesta d
-
d) Si aproximamos E = ΔG, y dado que ΔG = - nFe 0
Entonces para esta excitación de un solo electrón, E 0 = - ΔG/n F = - 1.91 x 10 5 J mol -1/(1 x 96,485 J V -1 mol -1) = -1.97 V
- Respuesta f
-
f) Dada la estructura del PDI, la transición es probablemente π —> π*.
- Respuesta g
-
g) La longitud de onda más larga absorbida se desplaza hacia el rojo, a aproximadamente 700 nm, después de sumergirse en ácido. La energía de la transición se baja a
E = h c/λ = (6.625 x 10 -34 Js mol -1 x 3.0 x 10 8 m s -1) /700 x 10 -9 m = 2.84 x 10 -19 J
E = 2.84 x 10 -19 J x NA = 3.18 x 10 -19 x 6.02 x 10 23 mol -1 = 1.71 x 10 5 J mol -1 = 171 kJ mol -1
- Respuesta h
-
h) Estas moléculas muy planas probablemente puedan apilarse muy firmemente juntas. La distancia entre los electrones π en una molécula y el orbital π* en una molécula vecina es muy pequeña. Es posible una transición intermolecular.
- Contestar i
-
i) ¿Qué sucede cuando la película se sumerge en ácido? Se protonó. Los grupos fosfato aniónicos se neutralizarían. Las moléculas serían capaces de apilarse aún más juntas, disminuyendo la energía requerida para excitar un electrón de una molécula a otra.
- Responder j
-
j) El inicio de la onda de reducción parece ser de aproximadamente -0.40 V, como lo muestra el pico en el voltamograma cíclico.
- Contestar m
-
m) E 0 (vs Ag+/AgCl) = E 0 (vs NHE) + 0.20 V (es decir, el potencial de reducción positiva de Ag+ vs NHE indica que un electrón es
i) E 0 (vs Ag+/AgCl) = - 0.10 V + 0.20 V = + 0.10 V
ii) E 0 (vs Ag+/AgCl) = + 1.23 V + 0.20 V = + 1.43 V
iii) E 0 (vs Ag+/AgCl) = + 0.83 V + 0.20 V = + 1.03 V
- Responder n
-
n) El estado excitado se puede reducir colocando un electrón en el agujero desocupado por el electrón excitado. Este nivel es 1.97 V por debajo de la banda de conductancia en energía, la cual tiene un potencial de reducción de -0.40 V (su potencial es 1.97 V más positivo que la banda de conductancia).
Así, -0.40 V + 1.97 V = + 1.57 V.
- Responder q
-
q) Los fosfatos probablemente se coordinan con el óxido de cobalto, formando un puente para la transferencia de electrones.
Ejercicio\(\PageIndex{2}\)
Investigadores en China han desarrollado nanopartículas de Ag-AgBr capaces de catalizar la degradación fotoquímica de contaminantes en la luz solar. (Langmuir 2010, 26, 18723-18727)
- Las nanopartículas de AgBr se forman primero mediante el autoclave de AgnO 3 y bromuro de tetraalquilamonio. Mostrar una ecuación para esta reacción.
- Las nanopartículas de AgBr absorben fuertemente entre 250-450 nm. ¿De qué color son?
- La estructura del AgBr se puede describir como bromuro cúbico centrado en la cara con plata en los agujeros octaédricos. Dibuja una celda unitaria.
Las nanopartículas de AgBr se suspenden en agua y se exponen a la luz solar durante varias horas hasta que se forman picopartículas de Ag en las superficies de las nanopartículas.
d) Comparar el tamaño de las nanopartículas con las picopartículas.
e) Se cree que la fotorreducción de plata implica la transferencia de electrones desde el disolvente. Mostrar un mecanismo para la formación de Ag (0).
f) Las nanopartículas de Ag-AgBr absorben fuertemente de 250-850 nm. ¿De qué color son?
En los ensayos de remediación, la naranja de metilo se utiliza como suplente para los contaminantes transportados por el agua. Los autores especulan que la absorción de fotones provoca pares electrón/agujero que conducen a la reducción de O 2 y oxidación del agua, respectivamente, generando especies reactivas de oxígeno.
h) Dibujar una imagen MO o banda gap para ayudar a ilustrar estos dos procesos (oxidación de agua y reducción de O 2).
i) Mostrar un mecanismo de propagación radical usando una especie reactiva de oxígeno y naranja de metilo.
- Contestar a
-
a) Ag + (aq) + NO 3 - (aq) + Bu 4 N + (aq) + Br - (aq) → AgBr (s) + Bu 4 N + (aq) + NO 3 - (aq)
- Respuesta b
-
b) Absorben en el rango violeta-azul y aparecerían amarillo-naranja.
- Respuesta d
-
d) Un nanómetro es de 10 a 9 m, mientras que un picómetro es de 10 a 12 m. Una picopartícula es 1,000 veces menor que una nanopartícula.
- Respuesta f
-
f) Absorben a través del espectro visible y aparecen negras.

