9.1: Soluciones a problemas seleccionados
- Page ID
- 79351
Ejercicio 9.2.1:
- azul y rojo; verde
- verde; rojo
- azul; naranja
- violeta
Ejercicio 9.2.2:
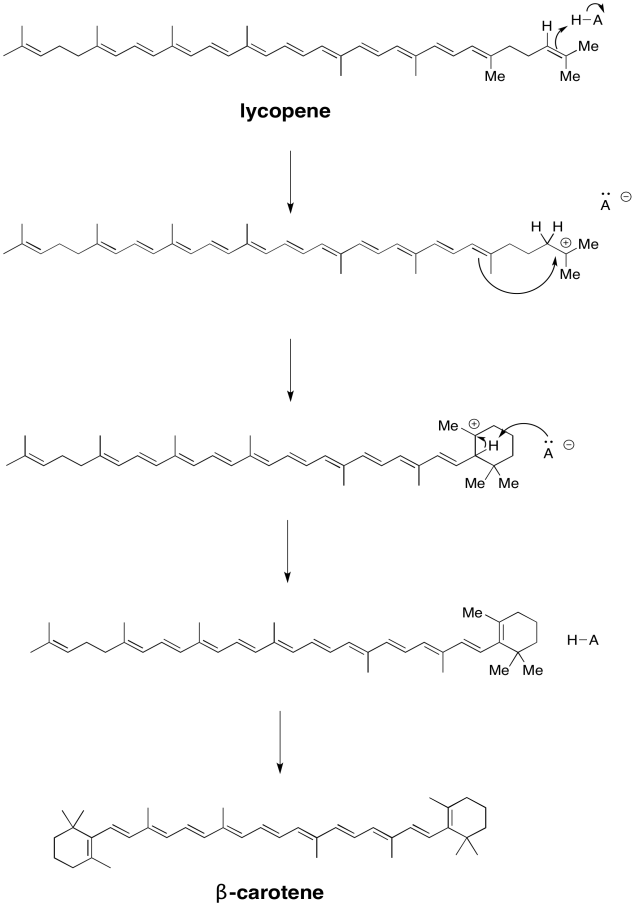
Ejercicio 9.2.3:

Ejercicio 9.3.1:
a)
b)
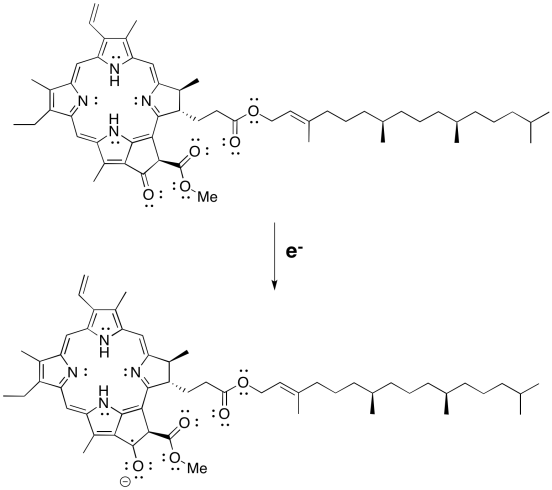
Ejercicio 9.3.2:
La feofitina b es probablemente más electrófila debido al grupo de formilo extra (-HC=O). A primera vista, se esperaría que tuviera un potencial de reducción más positivo.
Ejercicio 9.3.3:
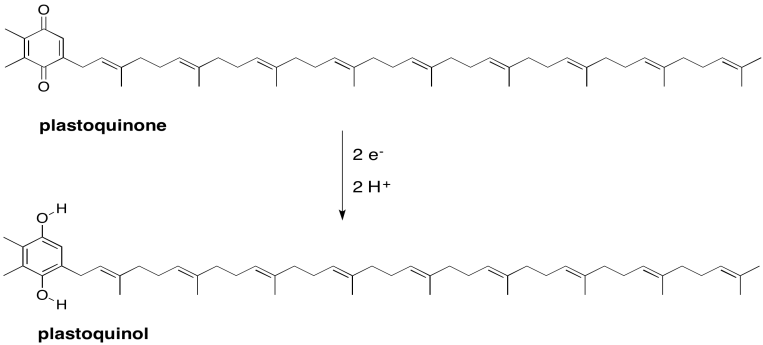
Ejercicio 9.3.4:
\[\Delta E = E^{o} (red) - E^{o} (ox) = 1.3 - 1.229 V = 0.07 V \nonumber\]
Ejercicio 9.3.5:

Ejercicio 9.4.1:
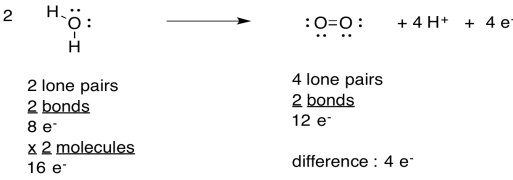
Ejercicio 9.4.2:
a) Fe (II, III) activo b) Mg (II) inactivo c) Cu (I, II) activo d) Li (I) inactivo
e) Zn (II) inactivo f) Sc (III) inactivo g) Co (II, III) activo h) Cr (II, III) activo
Ejercicio 9.5.1:
El primer par de plastoquinoles recicla dos electrones entre ellos, bombeando dos protones adicionales a través de un quinol reciclado. La salida de protones es 1.5 veces lo que sería sin el Q-loop (desde 1 protón/electrón + 0.5 protón/electrón). Ahora recuerda que este quinol reciclado también entrega dos electrones, uno de los cuales es reciclado. Para obtener un segundo electrón para generar un nuevo quinol reciclado, tendríamos que pasar de nuevo por todo el ciclo de dos nuevos plastoquinoles. Obtendríamos otros dos protones pero habría requerido ocho electrones para llegar allí, o 0.25 protones de salida por entrada de electrones. La salida de protones aumentaría a 1.75 veces lo que sería sin el bucle Q (desde 1 protón/electrón + 0.5 protón/electrón + 0.25 protón/electrón + 0.25 protón/electrón). Una serie resultará si seguimos adelante. La serie es de 1 + 1/2 + 1/4 + 1/8 + 1/16 +... + 1/2 n, y convergerá a 2. Por lo tanto, el bucle Q duplica el número de protones bombeados a través de la membrana.
Ejercicio 9.5.2:
El factor principal parece ser la estabilización de carga. Supongamos que ambos átomos de hierro comienzan como Fe (III). Tienen una carga total de 6 +. Los dos sulfuros son cada uno 2 -, para una carga total de núcleo Fe 2 S 2 de 2 +. Si se liga por cuatro cisteínas (Cys-S -), entonces la carga general del compuesto de coordinación es 2 -. La adición de un electrón resultará en un incremento en la carga negativa, a 3 -. Ahora, eso fue a partir del estado totalmente oxidado. Si en cambio comenzamos en un estado mixto de oxidación Fe (II/III), entonces la adición de un electrón da como resultado una carga 4 en el complejo de coordinación. Esa acumulación de carga será energéticamente difícil.
Si están ligadas por dos cisteínas (Cys-S -) y dos histidinas neutras, entonces la carga general del compuesto de coordinación es 0. La adición de un electrón resultará en una carga negativa, 1 -. Si en cambio comenzamos en un estado mixto de oxidación Fe (II/III), entonces la adición de un electrón da como resultado una carga 2 en el complejo de coordinación. Esa menor acumulación de carga requerida en este caso será energéticamente menos difícil.
Ejercicio 9.5.3:
El cobre está más a la derecha en la tabla periódica y, en consecuencia, es más electronegativo que el hierro. Esa es la razón principal por la que el cobre está por debajo del hierro en la serie de actividad o metales. Solo sobre esa base (e ignorando cualquier diferencia en el entorno de coordinación), podríamos esperar un potencial de reducción más positivo en un ion cobre que en un ion hierro. Por lo tanto, el cobre sería un mejor aceptor de electrones, y sería útil para crear una mayor fuerza impulsora para la transferencia de electrones más adelante en la cadena de transporte de electrones.
Ejercicio 9.5.4:
- Con un solo donante aniónico, la carga del complejo que contiene Cu (II) sería de 1 +.
- Con un donante aniónico, la carga del complejo que contiene Cu (I) sería 0.
- La reducción de plastocianina da como resultado una disminución de la carga, mientras que la reducción del grupo de FE resulta en un aumento de la carga. Ese factor por sí solo podría hacer que la plastocianina sea más fácil de reducir, con un potencial de reducción más positivo.
Ejercicio 9.6.1:
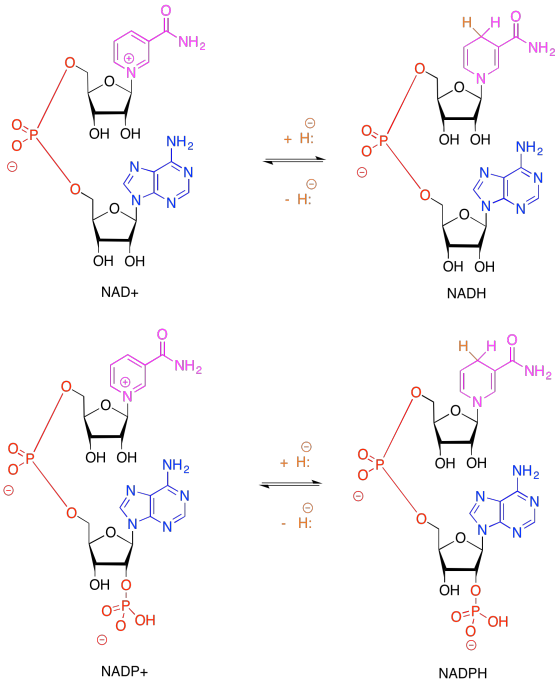
Ejercicio 9.6.2:
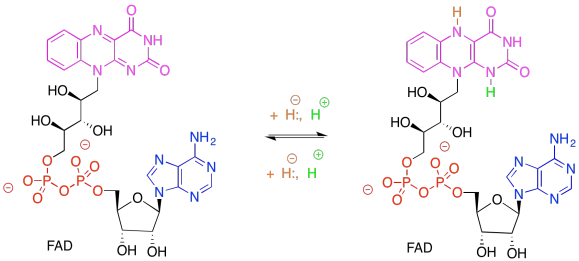
Ejercicio 9.6.3:
Recuerde, NADP+, como NAD+, es únicamente un agente oxidante de 2 electrones. Sólo puede recibir un par de electrones asociados a un hidruro. La ferredoxina, a través de un cúmulo de FeS, solo puede dar un electrón a la vez. Se necesita un adaptador entre estos dos portadores. El FAD puede aceptar 1 o 2 electrones, procediendo a cualquiera de los FADH . radical (estabilizado mediante deslocalización por resonancia extensa) o a FADH2.
Ejercicio 9.6.4:
- La liberación de moléculas de antenas del complejo de captación de luz en el fotosistema II disminuiría tanto el número de fotones capturados como el número de electrones enviados a la cadena de transporte de electrones. Por el contrario, en un modelo de “charco de cromóforos”, la liberación de estas moléculas del fotosistema II las haría más disponibles para su captación por el fotosistema I, resultando en una mayor absorción de fotones allí, y una mayor capacidad para aceptar electrones entrantes. Si están regulados, estos dos sistemas deberían poder nivelarse a una tasa idéntica de absorción de fotones.
- Las quinasas fosforilan las cadenas laterales hidroxi en residuos de serina (y a veces treoninas y tirosinas). Esa modificación covalente da como resultado un cambio en la carga de la cadena lateral de neutra a aniónica. Se puede esperar que se produzcan cambios conformacionales significativos en la proteína. Es probable que este cambio conformacional resulte en una unión más floja de las moléculas de antenas en el complejo de recolección de luz del fotosistema II.
Además, la quinasa parece promover una unión más estrecha de las moléculas de antenas en el fotosistema I, presumiblemente a través de un cambio conformacional allí. El resultado es un desplazamiento de estas moléculas del conjunto disponible, de tal manera que cromóforos adicionales están disponibles en el fotosistema I y menos se retienen en el fotosistema II, hasta que la absorción de fotones en los dos sitios es igual.
c) De hecho, la fosfatasa, que es la enzima complementaria a la quinasa, se activa cuando el fotosistema I tiene alta actividad en comparación con el fotosistema I. Las fosfatasas eliminan los grupos fosfato de las serinas y residuos relacionados. El resultado sería una unión más estrecha de las moléculas de antenas en el fotosistema I y una unión más floja de las moléculas de antenas en el fotosistema II, de manera que la absorción de luz podría igualarse entre los dos sitios.
El uso de fosfatasas y quinasas para lograr objetivos opuestos en la regulación es común en varios sistemas bioquímicos.
Ejercicio 9.8.1:
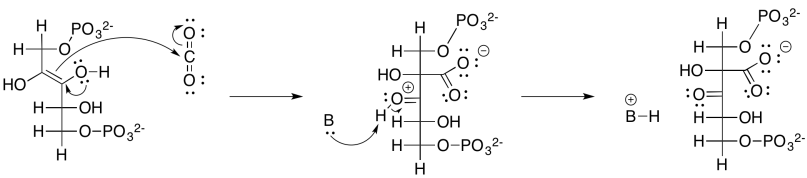
Ejercicio 9.8.2:
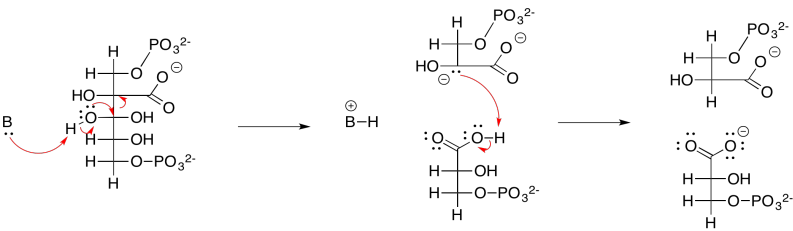
Ejercicio 9.8.3:
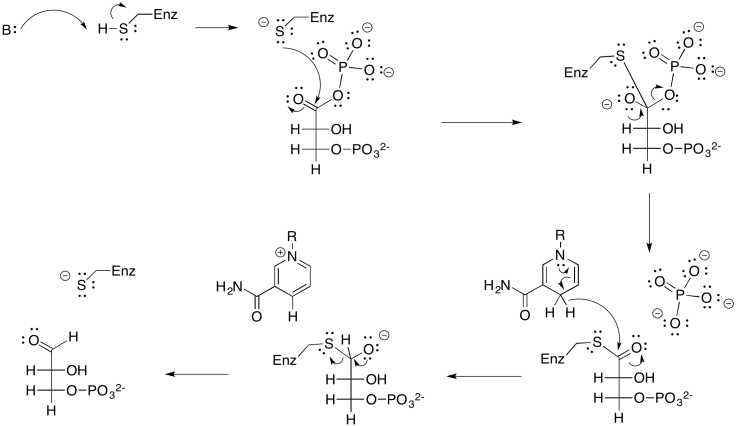
Ejercicio 9.8.4:

Ejercicio 9.8.5:
a)
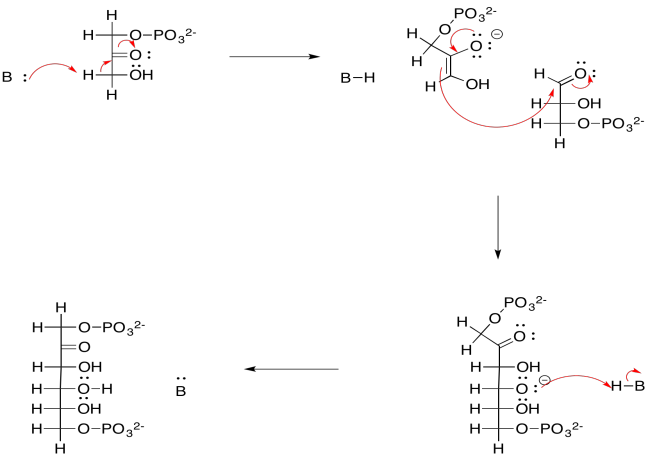
b)

Ejercicio 9.8.6:
a)
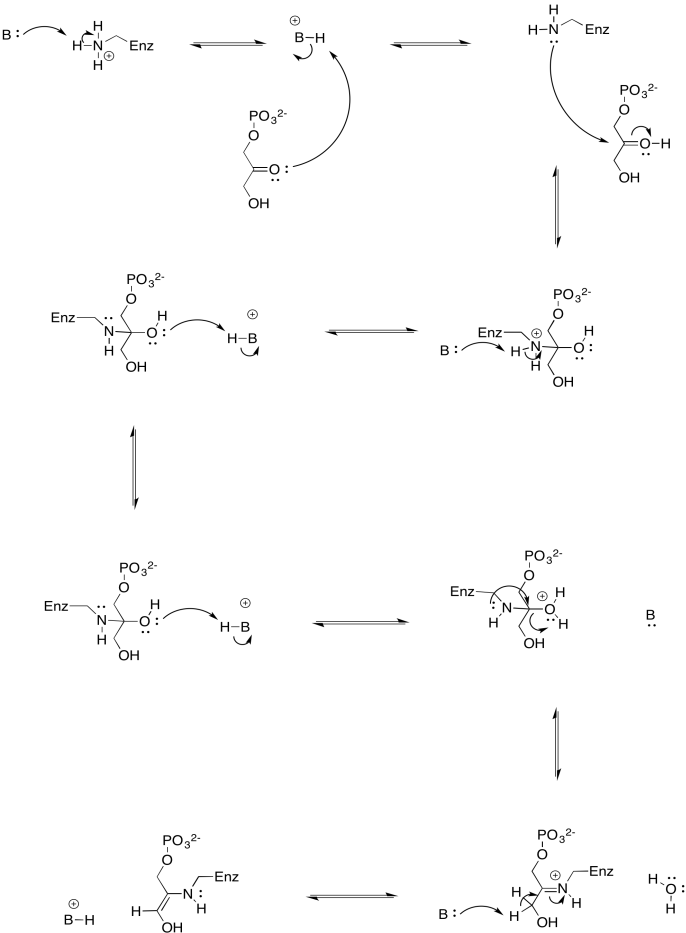
b)

Ejercicio 9.8.7:
La vía regular del enol es impulsada por la pi-donación de un átomo de oxígeno. La vía de la enamina es impulsada por pi-donación a partir de un nitrógeno. El nitrógeno es menos electronegativo y mejor donante pi que el oxígeno, por lo que la vía de la enamina es más rápida.
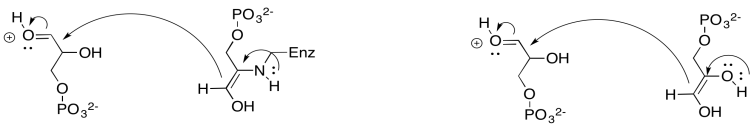
Ejercicio 9.8.8:
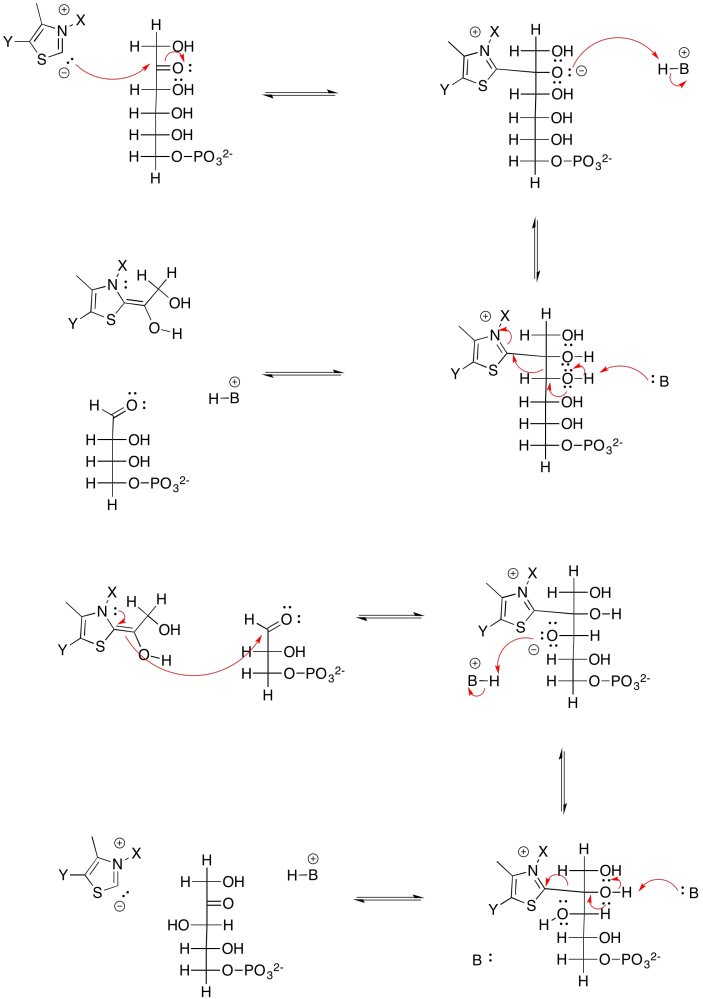
Ejercicio 9.8.9:
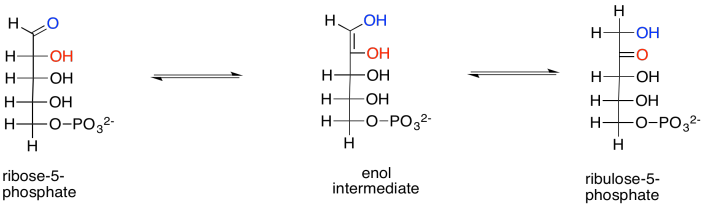
Ejercicio 9.8.10:
Las reacciones que están en equilibrio suelen estar bajo el control del sustrato. Debido a que la enzima puede catalizar la reacción en ambas direcciones, la dirección de la reacción impulsada por la enzima está controlada por la cantidad relativa de reactivos a cada lado de la reacción. Por ejemplo, si la concentración de xilulosa aumentara mucho, entonces la cantidad de xilulosa unida por la enzima también aumentaría, por lo que la enzima desplazaría la xilulosa en ribulosa y con ello mantendría el equilibrio. Si la concentración de ribulosa aumentara mucho, entonces la enzima uniría más ribulosa y la ribulosa se convertiría en xilulosa.
Ejercicio 9.9.1:
a)
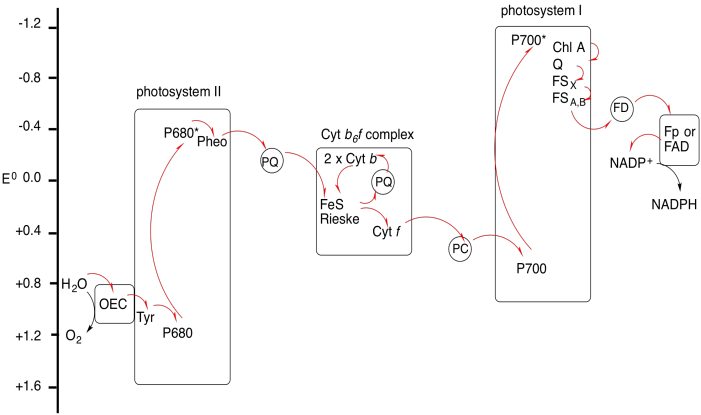
Ejercicio 9.9.2:


