15.8: Estados cuánticos, microestados y difusión de energía en reacciones
- Page ID
- 71071
Se espera que sea capaz de definir y explicar la significación de los términos identificados en negrita.
-
energía dentro de un sistema.
- La entropía de una sustancia aumenta con su peso molecular y complejidad y con la temperatura. La entropía también aumenta a medida que la presión o concentración se vuelve más pequeña. Las entropías de los gases son mucho mayores que las de las fases condensadas.
El significado físico de la entropía
La entropía es una medida del grado de dispersión y distribución de la energía térmica dentro de un sistema. Esta “difusión y distribución” puede ser la difusión de la energía térmica en un mayor volumen de espacio o su distribución entre microestados previamente inaccesibles del sistema. En la siguiente tabla se muestra cómo se aplica este concepto a una serie de procesos comunes.
| sistema y proceso | fuente de aumento de entropía del sistema |
|---|---|
| Se baraja una baraja de cartas, o se lanzan al azar 100 monedas, inicialmente con la cabeza hacia arriba. | Esto no tiene nada que ver con la entropía porque los macroobjetos son incapaces de intercambiar energía térmica con el entorno dentro de la escala de tiempo del proceso |
| Dos bloques idénticos de cobre, uno a 20°C y el otro a 40°C, se ponen en contacto. | El bloque más frío contiene más microestados desocupados, por lo que el calor fluye desde el bloque más cálido hasta que se pueblan números iguales de microestados en los dos bloques. |
| Un gas se expande isotérmicamente al doble de su volumen inicial. | Una cantidad constante de energía térmica se extiende sobre un mayor volumen de espacio |
| 1 mol de agua se calienta a 1C°. | El aumento de la energía térmica hace que los microestados adicionales sean accesibles. (El incremento es por un factor de alrededor de 10 20,000,000,000,000, 000,000,000.) |
| Se permiten mezclar volúmenes iguales de dos gases. | El efecto es el mismo que permitir que cada gas se expanda al doble de su volumen; la energía térmica en cada uno ahora se extiende sobre un volumen mayor. |
| Un mol de dihidrógeno, H 2, se coloca en un recipiente y se calienta a 3000K. | Algunos de los H 2 se disocian a H porque a esta temperatura hay más microestados térmicamente accesibles en los 2 moles de H. |
| La mezcla de reacción anterior se enfría a 300K. | La composición vuelve a prácticamente todo el H 2 debido a que esta molécula contiene más microestados térmicamente accesibles a bajas temperaturas. |
La entropía es una cantidad extensa; es decir, es proporcional a la cantidad de materia en un sistema; así 100 g de cobre metálico tiene el doble de entropía de 50 g a la misma temperatura. Esto tiene sentido porque la pieza más grande de cobre contiene el doble de niveles de energía cuantificados capaces de contener la energía térmica.
La energía térmica es la porción de energía de una molécula que es proporcional a su temperatura y, por lo tanto, se relaciona con el movimiento a escala molecular. ¿Qué tipo de movimientos moleculares son posibles? Para las moléculas monatómicas, solo hay una: el movimiento real de un lugar a otro, lo que llamamos traducción. Dado que hay tres direcciones en el espacio, todas las moléculas poseen tres modos de movimiento traslacional.
Para las moléculas poliatómicas, son posibles dos tipos adicionales de movimientos. Uno de ellos es la rotación; una molécula lineal como el CO 2 en la que todos los átomos están dispuestos a lo largo del eje x puede rotar a lo largo de los ejes y y z, mientras que las moléculas que tienen menos simetría pueden rotar alrededor de los tres ejes. Así, las moléculas lineales poseen dos modos de movimiento rotacional, mientras que las no lineales tienen tres modos rotacionales. Finalmente, las moléculas que constan de dos o más átomos pueden sufrir vibraciones internas. Para las moléculas que se mueven libremente en un gas, el número de modos o patrones vibracionales depende tanto del número de átomos como de la forma de la molécula, y aumenta rápidamente a medida que la molécula se vuelve más complicada.
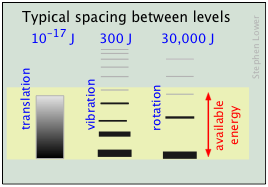
Las poblaciones relativas de los estados cuantificados de energía traslacional, rotacional y vibracional de una molécula diatómica típica se representan por el grosor de las líneas en este esquema (¡no a escala!) diagrama. El sombreado coloreado indica la energía térmica total disponible a una temperatura arbitraria. Los números en la parte superior muestran separaciones de orden de magnitud entre niveles adyacentes.
Observe que el espaciado entre los niveles traslacionales cuantificados es tan minúscula que pueden considerarse casi continuos. Esto significa que a todas las temperaturas, la energía térmica de una colección de moléculas reside casi exclusivamente en microestados traduccionales. A temperaturas ordinarias (alrededor de 25° C), la mayoría de las moléculas están en sus estados vibracionales y rotacionales de nivel cero (correspondientes a las barras más bajas en el diagrama). La prevalencia de estados vibracionales es tan abrumadora que podemos equiparar efectivamente la energía térmica de las moléculas con los movimientos traslacionales solos.
El número de formas en que la energía térmica puede distribuirse entre los estados permitidos dentro de una colección de moléculas se calcula fácilmente a partir de estadísticas simples. Un punto muy importante a tener en cuenta es que el número de microestados discretos que pueden ser poblados por una cantidad arbitraria de energía depende del espaciamiento de los estados. Como ejemplo muy sencillo, supongamos que tenemos dos moléculas (representadas por los puntos naranjas) en un sistema la energía térmica total disponible está indicada por el sombreado amarillo.
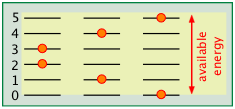
En el sistema con los niveles de energía más espaciados, hay tres microestados posibles, mientras que en el que tiene los niveles más espaciados, solo hay dos posibilidades disponibles.
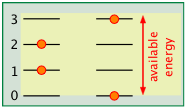
El espaciamiento de los estados de energía molecular se acerca a medida que aumenta la masa y el número de enlaces en la molécula, por lo que generalmente podemos decir que cuanto más compleja es la molécula, mayor es la densidad de sus estados energéticos.
A nivel atómico y molecular, se cuantifica toda la energía; cada partícula posee estados discretos de energía cinética y es capaz de aceptar energía térmica solo en paquetes cuyos valores corresponden a las energías de uno o más de estos estados. Las moléculas poliatómicas pueden almacenar energía en movimientos rotacionales y vibratorios, y todas las moléculas (incluso las monatómicas) poseerán energía cinética traslacional (energía térmica) a todas las temperaturas por encima del cero absoluto. La diferencia de energía entre los estados de traducción adyacentes es tan pequeña que la energía cinética traslacional puede considerarse continua (no cuantificada) para la mayoría de los propósitos prácticos.
El número de formas en que la energía térmica puede distribuirse entre los estados permitidos dentro de una colección de moléculas se calcula fácilmente a partir de estadísticas simples, pero aquí nos limitaremos a un ejemplo. Supongamos que tenemos un sistema que consta de tres moléculas y tres cuantos de energía para compartir entre ellas. Podemos darle toda la energía cinética a cualquier molécula, dejando a las otras sin ninguna, podemos dar dos unidades a una molécula y una unidad a otra, o podemos compartir la energía por igual y dar una unidad a cada molécula. Dicho todo, hay diez formas posibles de distribuir tres unidades de energía entre tres moléculas idénticas como se muestra aquí:
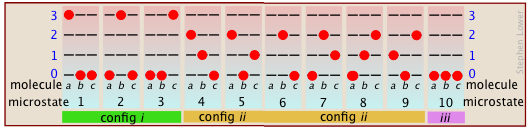
Cada una de estas diez posibilidades representa un microestado distinto que describirá el sistema en cualquier instante en el tiempo. Aquellos microestados que poseen distribuciones idénticas de energía entre los niveles cuánticos accesibles (y difieren solo en qué moléculas particulares ocupan los niveles) se conocen como configuraciones. Debido a que todos los microestados son igualmente probables, la probabilidad de cualquier configuración es proporcional al número de microestados que pueden producirla. Así, en el sistema mostrado anteriormente, la configuración etiquetada ii se observará 60% del tiempo, mientras que iii ocurrirá solo 10% del tiempo.
A medida que aumenta el número de moléculas y el número de cuantos, el número de microestados accesibles crece explosivamente; si 1000 cuanta de energía son compartidos por 1000 moléculas, el número de microestados disponibles será de alrededor de 10 600, un número que supera en gran medida el número de átomos en el observable universo! El número de configuraciones posibles (como se definió anteriormente) también aumenta, pero de tal manera que se reduce en gran medida la probabilidad de todas las configuraciones excepto las más probables. Así, para una muestra de un gas lo suficientemente grande como para ser observable en condiciones normales, solo se necesita considerar una única configuración (distribución de energía entre los estados cuánticos); incluso la segunda configuración más probable puede ser descuidada.
La conclusión: cualquier colección de moléculas lo suficientemente grandes en número como para tener importancia química tendrá su energía terrmal distribuida sobre un número inimaginablemente grande de microestados. El número de microestados aumenta exponencialmente a medida que más estados de energía (“configuraciones” como se definió anteriormente) se vuelven accesibles debido a
- Adición de cuantos de energía (temperatura más alta),
- Incremento en el número de moléculas (resultante de la disociación, por ejemplo).
- el volumen del sistema aumenta (lo que disminuye el espaciamiento entre los estados energéticos, permitiendo que más de ellos sean poblados a una temperatura dada.)
Uso de la entropía para comprender procesos espontáneos
Muerte por Calor
La energía se conserva; si levantas un libro de la mesa, y lo dejas caer, la cantidad total de energía en el mundo permanece sin cambios. Todo lo que has hecho es transferirlo de la forma en que estaba almacenada dentro de la glucosa en tu cuerpo a tus músculos, y luego al libro (es decir, trabajaste en el libro moviéndolo hacia arriba contra el campo gravitacional de la tierra). Después de que el libro ha caído, esta misma cantidad de energía existe que la energía térmica (calor) en el libro y la mesa.
Lo que ha cambiado, sin embargo, es la disponibilidad de esta energía. Una vez que la energía se ha extendido a la enorme cantidad de microestados térmicos en los objetos calentados, la probabilidad de que se desdisperse espontáneamente (es decir, por casualidad) es esencialmente cero. Así, aunque la energía sigue “ahí”, está para siempre más allá de la utilización o recuperación. La profundidad de esta conclusión se reconoció alrededor de 1900, cuando se describió por primera vez en la “muerte por calor” del mundo. Esto se refiere al hecho de que cada proceso espontáneo (esencialmente cada cambio que ocurre) va acompañado de la “dilución” de la energía. La implicación obvia es que toda la energía cinética a nivel molecular se esparcirá por completo, y nunca sucederá nada más.
Expansiones de Gases
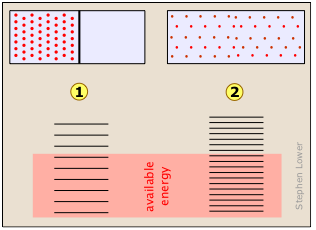
Todo el mundo sabe que un gas, si se deja solo, tenderá a expandirse y llenar el volumen dentro del cual está confinado completa y uniformemente. ¿Qué “impulsa” esta expansión? En el nivel más simple es claro que con más espacio disponible, los movimientos aleatorios de las moléculas individuales inevitablemente las dispersarán por todo el espacio. Pero como mencionamos anteriormente, los estados energéticos permitidos que las moléculas pueden ocupar están más espaciados en un volumen mayor que en uno más pequeño. Cuanto mayor sea el volumen disponible para el gas, mayor será el número de microestados que puede ocupar su energía térmica. Dado que todos estos estados dentro del rango de energías térmicamente accesibles son igualmente probables, la expansión del gas puede verse como consecuencia de la tendencia de la energía térmica a difundirse y compartirse lo más ampliamente posible. Una vez que esto ha sucedido, la probabilidad de que este reparto de energía se revierta (es decir, que el gas se contraiga espontáneamente) es tan mínima como para ser impensable.

Imagínese un gas inicialmente confinado a la mitad de una caja (Figura\(\PageIndex{4}\)). Luego se retira la barrera para que pueda expandirse en todo el volumen del contenedor. Sabemos que la entropía del gas aumentará a medida que la energía térmica de sus moléculas se propague al espacio agrandado. En cuanto a la dispersión de la energía térmica, la Figura\(\PageIndex{5}\) puede ser útil. La tendencia de un gas a expandirse se debe a los estados de energía térmica más espaciados en el mayor volumen .
.
Mezcla y dilución
Mezclar y diluir realmente equivalen a lo mismo, especialmente para los gases de idea. Reemplazar el par de recipientes mostrados anteriormente por uno que contenga dos tipos de moléculas en las secciones separadas (Figura\(\PageIndex{6}\)). Cuando eliminemos la barrera, las moléculas “rojas” y “azules” se expandirán cada una en el espacio de la otra. (Recordemos la Ley de Dalton que “cada gas es un vacío al otro gas”.) No obstante, observe que aunque cada gas sufrió una expansión, el proceso global equivale a lo que llamamos “mezcla”.

Lo que es cierto para las moléculas gaseosas puede, en principio, aplicarse también a las moléculas de soluto disueltas en un disolvente. Pero hay que tener en cuenta que mientras que la entalpía asociada a la expansión de un gas perfecto es por definición cero, Δ H de mezcla de dos líquidos o de disolución de un soluto en un disolvente tienen valores finitos que pueden limitar la miscibilidad de líquidos o la solubilidad de un soluto.
Es lamentable que los diagramas simplificados que estamos utilizando para ilustrar el mayor número de microestados energéticamente accesibles en un gas expandido o una mezcla de gases no logran transmitir la inmensidad de este aumento. Sólo trabajando a través de las matemáticas estadísticas de estos procesos (¡más allá del alcance de la Química de primer año!) se puede obtener una apreciación de la magnitud de las probabilidades de estos procesos espontáneos.
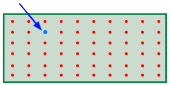
Resulta que cuando solo una molécula de un segundo gas se introduce en el contenedor de otro gas, se encuentra disponible un número inimaginablemente enorme de nuevas configuraciones. Esto sucede porque la molécula añadida (indicada por la flecha azul en el diagrama) puede en principio sustituir a cualquiera de las antiguas (rojas), dando lugar cada caso a un nuevo microestado.
Flujo de calor
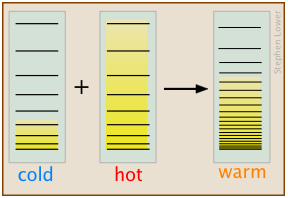
a medida que los gases cambian espontáneamente sus volúmenes de “más pequeños a grandes”, el flujo de calor de un cuerpo más cálido a uno más frío siempre opera en la dirección “más caliente a más frío” porque esto permite que la energía térmica pueble un mayor número de microestados de energía a medida que se ponen a disposición otros nuevos al traer el cuerpo más frío en contacto con el más cálido; en efecto, la energía térmica se vuelve más “diluida”. En este diagrama esquemático simplificado, los cuerpos “fríos” y “calientes” difieren en el número de microestados traslacionales que están ocupados, como lo indica el sombreado. Cuando se ponen en contacto térmico, se crea un número enormemente mayor de microestados, como lo indica su espaciado más cercano en la sección más a la derecha del diagrama, que representa los cuerpos combinados en equilibrio térmico. La energía térmica en los dos cuerpos iniciales llena estos nuevos microestados a un nivel (y por lo tanto, temperatura) que se encuentra en algún lugar entre los de los dos cuerpos originales.
Tenga en cuenta que esta explicación se aplica igualmente bien al caso de dos sólidos puestos en contacto térmico, o dos la mezcla de dos fluidos que tienen diferentes temperaturas.
Como cabría esperar, el aumento en la cantidad de energía que se esparce y comparte es proporcional a la cantidad de calor transferido q, pero hay otro factor involucrado, y esa es la temperatura a la que se produce la transferencia. Cuando una cantidad de calor q pasa a un sistema a temperatura T, el grado de dilución de la energía térmica viene dado por
\[\dfrac{q}{T}\]
Para entender por qué tenemos que dividir por la temperatura, consideremos el efecto de valores muy grandes y muy pequeños de\(T\) en el denominador. Si el cuerpo que recibe el calor está inicialmente a una temperatura muy baja, inicialmente se ocupan relativamente pocos estados de energía térmica, por lo que la cantidad de energía que se extiende a estados vacantes puede ser muy grande. Por el contrario, si la temperatura es inicialmente grande, ya se esparce más energía térmica en su interior, y la absorción de la energía adicional tendrá un efecto relativamente pequeño en el grado de trastorno térmico dentro del cuerpo.
Reacciones Químicas y Equilibrio
Cuando se produce una reacción química, se involucran dos tipos de cambios relacionados con la energía térmica:
- Las formas en que se puede almacenar la energía térmica dentro de los reactivos generalmente serán diferentes de las de los productos. Por ejemplo, en la reacción H 2 → 2 H, el reactivo dihidrógeno posee estados de energía vibracional y rotacional, mientras que el hidrógeno atómico en el producto solo tiene estados de traslación, pero el número total de estados de traslación en dos moles de H es dos veces mayor que en un mol de H 2 . Debido a su espaciado extremadamente cercano, los estados de traslación son los únicos que realmente cuentan a temperaturas ordinarias, por lo que podemos decir que la energía térmica puede llegar a diluirse dos veces (“esparcirse”) en el producto que en el reactivo. Si este fuera el único factor a considerar, entonces la disociación del dihidrógeno siempre sería espontánea y esta molécula no existiría.
- Para que esta disociación ocurra, sin embargo, se\(q =ΔU\) debe tomar una cantidad de energía térmica (calor) del entorno para romper el enlace H-H. Es decir, el estado fundamental (la energía a la que comienza el colector de estados energéticos) es mayor en\(H\), como lo indica el desplazamiento vertical de la mitad derecha en cada uno de los cuatro paneles inferiores.
En la Figura\(\PageIndex{8}\) a re representaciones esquemáticas de los niveles de energía traslacional de los dos componentes H y H2 de la reacción de disociación de hidrógeno. El sombreado muestra cómo las poblaciones relativas de microestados ocupados varían con la temperatura, provocando que la composición de equilibrio cambie a favor del producto de disociación.
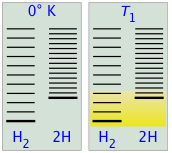
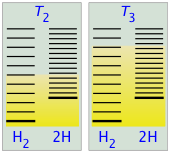
La capacidad de la energía para propagarse en las moléculas del producto está limitada por la disponibilidad de energía térmica suficiente para producir estas moléculas. Aquí es donde entra la temperatura. A cero absoluto la situación es muy simple; no hay energía térmica disponible para provocar la disociación, por lo que el único componente presente será el dihidrógeno.
- A medida que aumenta la temperatura, aumenta el número de estados energéticos poblados, como lo indica el sombreado en el diagrama. A temperatura T 1, el número de estados poblados de H 2 es mayor que el de 2H, por lo que algunos de estos últimos estarán presentes en la mezcla de equilibrio, pero sólo como componente minoritario.
- A alguna temperatura T 2 los números de estados poblados en los dos componentes del sistema de reacción serán idénticos, por lo que la mezcla de equilibrio contendrá H 2 y “2H” en cantidades iguales; es decir, la relación molar de H 2/H será 1:2.
- A medida que la temperatura sube a T 3 y superiores, vemos que el número de estados energéticos que son térmicamente accesibles en el producto comienza a superar el del reactivo, favoreciendo así la disociación.
El resultado es exactamente lo que predice el Principio de Le Chatelier: el estado de equilibrio para una reacción endotérmica se desplaza hacia la derecha a temperaturas más altas.
La siguiente tabla generaliza estas relaciones para las cuatro combinaciones de signo de ΔH y ΔS. (Obsérvese que el uso de los valores estándar ΔH° y ΔS° en las reacciones de ejemplo no es estrictamente correcto aquí, y puede producir resultados engañosos cuando se usan generalmente).
> 0

Esta reacción de combustión, como la mayoría de tales reacciones, es espontánea a todas las temperaturas. El cambio de entropía positivo se debe principalmente a la mayor masa de moléculas de CO 2 en comparación con las de O 2.
< 0

- Δ H° = —46.2 kJ
- Δ S° = —389 J K —1
- Δ G° = —16.4 kJ a 298 K
La disminución de moles de gas en la síntesis de amoníaco de Haber impulsa el cambio de entropía negativo, haciendo que la reacción sea espontánea solo a bajas temperaturas. Así, una T más alta, que acelera la reacción, también reduce su extensión.
> 0

- Δ H° = 55.3 kJ
- Δ S° = +176 J K —1
- Δ G° = +2.8 kJ a 298 K
Las reacciones de disociación son típicamente endotérmicas con cambio de entropía positivo y, por lo tanto, son espontáneas a altas temperaturas. En última instancia, todas las moléculas se descomponen en sus átomos a temperaturas suficientemente altas.
< 0

- Δ H° = 33.2 kJ
- ΔS° = —249 J K — 1
- Δ G° = +51.3 kJ a 298 K
Esta reacción no es espontánea a ninguna temperatura, lo que significa que su reverso siempre es espontáneo. Pero debido a que la reacción inversa está cinéticamente inhibida, el NO 2 puede existir indefinidamente a temperaturas ordinarias aunque sea termodinámicamente inestable.
Cambios de fase
Todo el mundo sabe que el sólido es la forma estable de una sustancia a bajas temperaturas, mientras que el estado gaseoso prevalece a altas temperaturas. ¿Por qué debería ser esto? El diagrama de la Figura\(\PageIndex{9}\) muestra que
- la densidad de los estados energéticos es menor en el sólido y mayor (mucho, mucho mayor) en el gas, y
- los estados terrestres del líquido y del gas se compensan con respecto al estado anterior por los calores de fusión y vaporización, respectivamente.

Los cambios de fase implican intercambio de energía con el entorno (cuyo contenido energético relativo al sistema se indica (¡con mucha exageración!) por la altura de las barras verticales amarillas en la Figura\(\PageIndex{13}\). Cuando el sólido y el líquido están en equilibrio (sección media del diagrama a continuación), hay suficiente energía térmica (indicada por sombreado rosado) para poblar los estados energéticos de ambas fases. Si se permite que el calor fluya hacia el entorno, se retira selectivamente de los niveles más abundantemente poblados de la fase líquida, haciendo que la cantidad de esta fase disminuya a favor del sólido. La temperatura permanece constante ya que el calor de fusión se devuelve al sistema en compensación exacta por el calor perdido en los alrededores. Por último, después de que el último rastro de líquido haya desaparecido, los únicos estados que quedan son los del sólido. Cualquier extracción adicional de calor da como resultado una caída de temperatura a medida que los estados del sólido se despoblan.

Propiedades coligativas de las soluciones
La disminución de la presión de vapor, la elevación del punto de ebullición, la depresión del punto de congelación y la ósmosis son fenómenos bien conocidos que ocurren cuando un soluto no volátil como el azúcar o una sal se disuelve en un disolvente volátil como el agua. Todos estos efectos resultan de la “dilución” del disolvente por el soluto agregado, y debido a esta comunalidad se les conoce como propiedades coligativas (Lat. co ligare, conectado a.) El papel clave de la concentración de disolvente se ve oscurecido por las expresiones muy simplificadas utilizadas para calcular la magnitud de estos efectos, en las que solo aparece la concentración de soluto. Los detalles de cómo llevar a cabo estos cálculos y las muchas aplicaciones importantes de las propiedades coligativas se cubren en otra parte. Nuestro propósito aquí es ofrecer una explicación más completa de por qué ocurren estos fenómenos.
Básicamente, todos estos resultan del efecto de dilución del disolvente sobre su entropía, y así en el incremento en la densidad de estados energéticos del sistema en la solución respecto a la del líquido puro. El equilibrio entre dos fases (líquido-gas para ebullición y sólido-líquido para congelación) ocurre cuando los estados energéticos en cada fase pueden ser poblados a densidades iguales. Las temperaturas a las que esto ocurre son representadas por el sombreado.

La dilución del solvente agrega nuevos estados de energía al líquido, pero no afecta la fase de vapor. Esto eleva la temperatura requerida para hacer accesibles números iguales de microestados en las dos fases.

La dilución del solvente agrega nuevos estados de energía al líquido, pero no afecta a la fase sólida. Esto reduce la temperatura requerida para hacer accesible el mismo número de estados en las dos fases.
Presión osmótica: efectos de la presión sobre la entropía
Cuando un líquido es sometido a presión hidrostática, por ejemplo, por un gas inerte y no disolvente que ocupa el espacio de vapor por encima de la superficie, se eleva la presión de vapor del líquido (Figura\(\PageIndex{13}\)). La presión actúa comprimiendo el líquido muy ligeramente, estrechando efectivamente el pozo de energía potencial en el que residen las moléculas individuales y aumentando así su tendencia a escapar de la fase líquida. (Debido a que los líquidos no son muy compresibles, el efecto es bastante pequeño; una presión aplicada de 100 atm elevará la presión de vapor del agua a 25°C en solo aproximadamente 2 torr.) En cuanto a la entropía, podemos decir que la presión aplicada reduce las dimensiones de la “caja” dentro de la cual los principales movimientos de traslación de las moléculas están confinados dentro del líquido, reduciendo así la densidad de estados energéticos en la fase líquida.

La aplicación de presión hidrostática a un líquido aumenta el espaciamiento de sus microestados, de manera que el número de estados energéticamente accesibles en el gas, aunque sin cambios, es relativamente mayor, aumentando así la tendencia de las moléculas a escapar a la fase de vapor. En términos de energía libre, la mayor presión eleva la energía libre del líquido, pero no afecta la de la fase gaseosa.

Este fenómeno puede explicar la presión osmótica. La presión osmótica, se debe recordar a los estudiantes, no es lo que impulsa la ósmosis, sino más bien la presión hidrostática que se debe aplicar a la solución más concentrada (disolvente más diluido) para detener el flujo osmótico de disolvente hacia la solución. El efecto de esta presión\(\Pi\) es aumentar ligeramente el espaciamiento de los estados de energía del disolvente en el lado de alta presión (dilución-disolvente) de la membrana para que coincida con el del disolvente puro, restaurando el equilibrio osmótico.

