15.7: Algunas aplicaciones de la entropía y la energía libre
- Page ID
- 71019
Se espera que pueda definir y explicar la importancia de los términos identificados en negrita
- ¿Qué tienen en común todas las propiedades coligativas de las soluciones en términos de entropía?
- En los puntos de fusión y ebullición, las dos fases en equilibrio tienen el mismo número de microestados energéticamente accesibles. ¿Cómo altera este equilibrio la adición de un soluto no volátil en los dos casos?
- Describir el efecto de aumentar la presión hidrostática sobre un líquido tiene sobre su presión de vapor, y sugerir una razón para ello.
- ¿Bajo qué condiciones ocurre el flujo osmótico? ¿Cuál es la fuerza impulsora fundamental? ¿Cuál es la definición de presión osmótica?
- Explicar el papel crítico de la temperatura en la extracción de metales de sus minerales de óxido.
- Describir el ciclo bioenergético de la energía libre en términos de los roles de glucosa, aceptores de electrones, ATP y fotosíntesis.
- Definir la oxidación aeróbica y no aeróbica, y explicar por qué difieren en eficiencia.
- Esboce un diagrama simple de energía libre de protones que muestre por qué un ácido reacciona con una base.
- Esboce un diagrama simple de energía libre de electrones que muestre por qué un metal reacciona con un agente oxidante que está debajo de él en la serie electromotriz.
- ¿Qué factores termodinámicos están involucrados en la contracción espontánea de un material elástico como una goma elástica?
La termodinámica puede parecer al principio como un tema bastante esotérico, pero cuando se piensa en ello, casi todos los procesos químicos (y biológicos) se rigen por cambios en la entropía y la energía libre. Ejemplos como los que se dan a continuación deberían ayudarte a conectar estos conceptos con el mundo real.
Propiedades coligativas de las soluciones
La disminución de la presión de vapor, la elevación del punto de ebullición, la depresión del punto de congelación y la ósmosis son fenómenos bien conocidos que ocurren cuando un soluto no volátil como el azúcar o una sal se disuelve en un disolvente volátil como el agua. Todos estos efectos resultan de la “dilución” del disolvente por el soluto agregado, y debido a esta comunalidad se les conoce como propiedades coligativas (Lat. co ligare, conectado a.) El papel clave de la concentración de disolvente se ve oscurecido por las expresiones utilizadas para calcular la magnitud de estos efectos, en las que solo aparece la concentración de soluto. Los detalles de cómo llevar a cabo estos cálculos y las muchas aplicaciones importantes de las propiedades coligativas se cubren en la unidad sobre soluciones. Nuestro propósito aquí es ofrecer una explicación más completa de por qué ocurren estos fenómenos.
La explicación convencional es que la dilución de un líquido por un soluto no volátil reduce la presión de vapor o “tendencia a escapar” del líquido en esa fase, conduciendo a un transporte neto de material a esa fase. El equilibrio se puede restablecer ajustando la temperatura de aplicar una presión hidrostática a la solución. La fase estable a cualquier temperatura será aquella que tenga la menor energía libre, y de la cual las moléculas tengan la menor tendencia a escapar.
Un enfoque más fundamental es recordar que la dilución de un líquido crea un número incontable de nuevos microestados, aumentando la densidad de estados cuánticos en la solución en comparación con la del líquido puro. En la medida en que estos nuevos estados sean térmicamente accesibles, se poblarán a expensas de algunos de los microestados de la otra fase. El equilibrio entre dos fases puede restaurarse ajustando la temperatura o presión para que se ocupen números iguales de microestados en cada fase.
Elevación del punto de ebullición y depresión del punto de
Estos efectos se entienden fácilmente en términos de los diagramas esquemáticos que se muestran a continuación. El sombreado rojo indica las temperaturas requeridas para hacer que números iguales de microestados sean térmicamente accesibles en las dos fases.
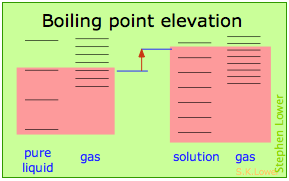
La dilución del solvente agrega nuevos estados de energía al líquido, pero no afecta la fase de vapor. Esto eleva la temperatura requerida para hacer accesibles números iguales de microestados en las dos fases.
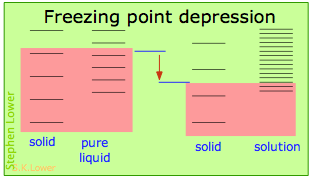
La dilución del solvente agrega nuevos estados de energía al líquido, pero no afecta a la fase sólida. Esto reduce la temperatura requerida para hacer accesible el mismo número de estados en las dos fases. Los desplazamientos de los puntos de ebullición y congelación en direcciones opuestas reflejan las energías superiores de los microestados de vapor y las energías más bajas de los microestados sólidos en relación con las del líquido. ¡Tenga en cuenta que estos diagramas son puramente esquemáticos y no están cerca de escala!
Como se mencionó anteriormente, la explicación más convencional de elevación de pb y depresión fp se da en términos de presiones de vapor. Estas últimas son medidas de las energías libres de moléculas en una fase, y las relaciones se entienden mejor mostrando gráficas de — T Δ S° para cada fase en términos de la temperatura:

Puntos de fusión y ebullición de una sustancia pura.
La fase estable a cualquier temperatura será aquella que tenga la menor energía libre, y de la cual las moléculas tengan la menor tendencia a escapar.
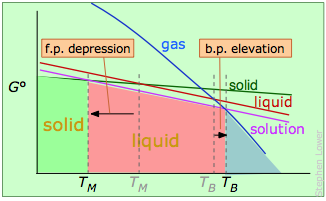
Puntos de fusión y ebullición de un disolvente que contiene un soluto no volátil.
El soluto “diluye” el disolvente, reduciendo su energía libre (línea púrpura) y desplazando las temperaturas de transición en direcciones opuestas.
La presión sobre un líquido afecta su volatilidad
Cuando un líquido es sometido a presión hidrostática, por ejemplo, por un gas inerte y no disolvente que ocupa el espacio de vapor por encima de la superficie, se eleva la presión de vapor del líquido. La presión actúa comprimiendo el líquido muy ligeramente, estrechando efectivamente el pozo de energía potencial en el que residen las moléculas individuales y aumentando así su tendencia a escapar de la fase líquida. (Debido a que los líquidos no son muy compresibles, el efecto es bastante pequeño; una presión aplicada de 100 atm elevará la presión de vapor del agua a 25° C en solo aproximadamente 2 torr.) En cuanto a la entropía, podemos decir que la presión aplicada reduce las dimensiones de la “caja” dentro de la cual los principales movimientos de traslación de las moléculas están confinados dentro del líquido, reduciendo así la densidad de los estados energéticos cuantificados en la fase líquida.

Por qué la presión afecta la volatilidad de un líquido. La aplicación de presión hidrostática a un líquido aumenta el espaciamiento de sus microestados, de manera que el número de estados energéticamente accesibles en el gas, aunque sin cambios, es relativamente mayor, aumentando así la tendencia de las moléculas a escapar a la fase de vapor. En términos de energía libre, la mayor presión eleva la energía libre del líquido, pero no afecta la de la fase gaseosa.
Flujo osmótico y presión osmótica
Las moléculas en un fluido siempre están sujetas a movimientos térmicos aleatorios. Si un determinado tipo de molécula está presente en mayor concentración en una región de un fluido, el efecto de estos movimientos aleatorios será producir una migración neta hacia la región de menor concentración; esta migración se conoce como difusión térmica.
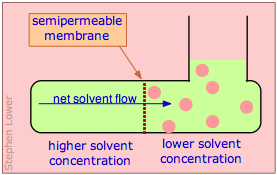
El flujo osmótico (comúnmente conocido simplemente como ósmosis) ocurre cuando las moléculas de un disolvente se difunden a través de una membrana que es permeable solo a esas moléculas, y en una solución en la que el disolvente se “diluye” por la presencia de moléculas de soluto. En el ejemplo más simple, hay disolvente puro en el lado izquierdo de la membrana; en el otro lado el mismo disolvente contiene un soluto cuyas moléculas son demasiado grandes para pasar a través de la membrana. Debido a que la concentración de disolvente en el lado derecho siempre será menor que la de la izquierda, el flujo osmótico continuará indefinidamente si el lado derecho puede acomodar el volumen aumentado.

Sin embargo, si el líquido en el lado derecho de la membrana se coloca bajo presión hidrostática, la fuerza impulsora para el flujo osmótico disminuirá. Si la presión se eleva suficientemente alta, el flujo osmótico se detendrá; entonces se dice que el sistema está en equilibrio osmótico. La presión requerida para lograr el equilibrio osmótico (y así detener el flujo osmótico) se conoce como la presión osmótica, comúnmente denotada por π (pi mayúscula griega).
El equilibrio osmótico, como cualquier tipo de equilibrio, ocurre cuando las energías libres (es decir, las tendencias de escape) de las moléculas difusibles son las mismas en los dos lados de la membrana. La energía libre en el lado derecho, inicialmente menor debido a la menor concentración de disolvente, es elevada por la presión hidrostática, haciéndola idéntica a la del líquido puro de la izquierda.
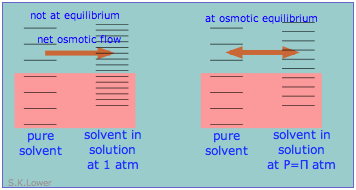
Desde el punto de vista de los estados de energía microscópicos, el efecto de la presión aplicada es aumentar ligeramente el espaciamiento de los estados de energía solvente en el lado derecho de la membrana para igualar el número de estados accesibles en los dos lados, como se muestra aquí de una manera muy esquemática.
Extracción de Metales de sus Óxidos
Desde la antigüedad, la recuperación de metales de sus minerales ha sido una de las aplicaciones más importantes de la química para la civilización y la cultura. El proceso de fundición más antiguo y aún más común para los minerales de óxido implica calentarlos en presencia de carbono. Originalmente se utilizó carbón vegetal, pero la fundición a escala industrial utiliza coque, una forma cruda de carbono preparada por pirólisis (calentamiento) de carbón. Las reacciones básicas son:
\[MO + C \rightleftharpoons M + CO \label{2.1}\]
\[MO + ½ O_2 \rightleftharpoons M + ½ CO_2 \label{2.2}\]
\[MO + CO \rightleftharpoons M + CO_2 \label{2.3}\]
Cada una de estas puede considerarse como un par de reacciones acopladas en las que el metal M y el carbono están compitiendo efectivamente por el átomo de oxígeno. Usando la reacción\(\ref{2.1}\) como ejemplo, se puede desglosar en las siguientes dos partes:
\[MO \rightleftharpoons M + ½ O_2 \;\;\; ΔG^o > 0 \label{2.4}\]
\[C + ½ O_2 \rightleftharpoons CO \;\;\; ΔG^o < 0 \label{2.5}\]
A temperaturas ambientales ordinarias, la reacción siempre\(\ref{2.4}\) es espontánea en la dirección inversa (¡es por eso que se forman minerales en primer lugar!) , por lo que Δ G° de Reacción\(\ref{2.4}\) será positiva. Δ G° para la reacción siempre\(\ref{2.5}\) es negativo, pero a bajas temperaturas no será lo suficientemente negativo para conducir\(\ref{2.4}\).
El proceso de fundición depende de las diferentes formas en que las energías libres de las reacciones les gusta\(\ref{2.4}\) y\(\ref{2.4}\) varían con la temperatura. Esta dependencia de la temperatura está dominada casi en su totalidad por el término T Δ S° en la función de Gibbs, y así por el cambio de entropía. Este último depende principalmente de Δ n g, el cambio en el número de moles de gas en la reacción. La remoción de oxígeno del mineral siempre va acompañada de un gran aumento en el volumen del sistema por lo que Δ S para esta etapa siempre es positiva y la reacción se vuelve más espontánea a temperaturas más altas. Las dependencias de temperatura de las reacciones que absorben oxígeno varían, sin embargo (Cuadro 23.6.X).
|
Reacción
|
Δ n g
|
d (Δ G°)/dT
|
|---|---|---|
| C + ½ O 2 → CO |
0.5
|
<0>
|
| C + O 2 → CO 2 |
0
|
0
|
| CO + ½ O 2 →CO 2 |
—0.5
|
>0
|
Una gráfica de las dependencias de temperatura de las energías libres de estas reacciones, superpuestas en gráficas similares para las reacciones de eliminación de oxígeno\(\ref{2.4}\) se denomina diagrama de Ellingham. Para que un MO de óxido dado sea fundible, la temperatura debe ser lo suficientemente alta como para que la reacción\(\ref{2.4}\) caiga por debajo de la de al menos una de las reacciones que consumen oxígeno. Las pendientes de las líneas en este diagrama están determinadas por el signo del cambio de entropía.
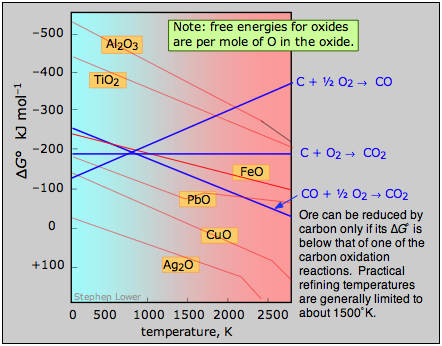
El examen del diagrama de Ellingham mostrado anteriormente ilustra por qué los metales conocidos por los antiguos eran principalmente aquellos como el cobre y el plomo, los cuales se pueden obtener fundiendo a las temperaturas relativamente bajas que se podían obtener por los métodos disponibles en el momento en que un fuego de carbón suministraba tanto el el calor y el carbono. Así la edad del bronce precedió a la edad del hierro; esta última tuvo que esperar el desarrollo de tecnología capaz de producir temperaturas más altas, como el alto horno. La fundición de óxido de aluminio por carbono requiere temperaturas demasiado altas para ser prácticas; la producción comercial de aluminio se logra por electrólisis del mineral fundido.
Bioenergética
Muchas de las reacciones que tienen lugar en los organismos vivos requieren de una fuente de energía libre para impulsarlos. La fuente inmediata de esta energía en los organismos heterótrofos, que incluyen animales, hongos y la mayoría de las bacterias, es la glucosa de azúcar. La oxidación de la glucosa a dióxido de carbono y agua se acompaña de un gran cambio negativo de energía libre
\[\ce{C6H12O6 + 6 O2 \rightarrow 6 CO2 + 6 H2O} \quad ΔG^o = – 2,880 \,kJ\, mol^{–1} \label{6-1}\]
Por supuesto que no serviría para simplemente “quemar” la glucosa de la manera normal; el cambio de energía se desperdiciaría como calor, ¡y más bien demasiado rápido para el bienestar del organismo! La utilización efectiva de esta energía libre requiere un medio para capturarla de la glucosa y luego liberarla en pequeñas cantidades cuando y donde se necesite. Esto se logra descomponiendo la glucosa en una serie de una docena o más pasos en los que la energía liberada en cada etapa es capturada por una molécula “portadora de energía”, de la cual la más importante es el difosfato de adenosina, conocido como ADP. En cada paso de la descomposición de la glucosa, una molécula de ADP reacciona con fosfato inorgánico (denotado por P i) y cambia a ATP:
\[ADP + P_i \rightarrow ATP\]
\[ΔG^° = +30 \;kJ\; mol^{–1} \label{(6-2}\]


Los 30 kJ mol —1 de energía libre almacenada en cada molécula de ATP se liberan cuando la molécula viaja a un sitio donde se necesita y pierde uno de sus grupos fosfato, produciendo fosfato inorgánico y ADP, que finalmente encuentra su camino de regreso al sitio del metabolismo de la glucosa para reciclarse nuevamente en ATP. La descomposición completa de una molécula de glucosa se acopla con la producción de 38 moléculas de ATP de acuerdo con la reacción general
\[\ce{C6H12O6 + 6 O2 + 38 Pi + 38 ADP 38 ATP + 6CO2 + 44 H2O} \label{6-3}\]
Por cada mol de glucosa metabolizada, 38 × (30 kJ) = 1140 kJ de energía libre se captura como ATP, lo que representa una eficiencia energética de 1140/2880 = 0.4. Es decir, el 40% de la energía libre que se obtiene de la oxidación de la glucosa se pone a disposición para impulsar otros procesos metabólicos. El resto se libera como calor.
¿De dónde viene la glucosa? Los animales obtienen su glucosa de su alimento, especialmente celulosa y almidones que, al igual que la glucosa, tienen la fórmula empírica {CH 2 O}. Los animales obtienen este alimento comiendo plantas u otros animales. En última instancia, todos los alimentos provienen de las plantas, la mayoría de las cuales son capaces de producir su propia glucosa a partir de CO 2 y H 2 O a través del proceso de fotosíntesis. Esto es solo lo contrario de la Eq 40 en la que la energía libre es suministrada por los cuantos de luz absorbida por la clorofila y otros pigmentos fotosintéticos.
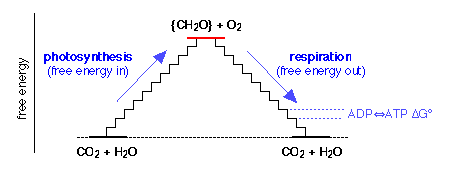
Esto describe la respiración aeróbica, que evolucionó después de que el desarrollo de la vida fotosintética en la Tierra comenzara a elevar la concentración de oxígeno atmosférico. El oxígeno es un veneno para la mayoría de los procesos de la vida a nivel celular, y se cree que la respiración aeróbica se desarrolló como un medio para proteger a los organismos de este peligro. Aquellos que no se adaptaron literalmente han “pasado a la clandestinidad” y constituyen las bacterias anaerobias más primitivas.
La función del oxígeno en la respiración es servir como aceptor de los electrones que pierde la glucosa cuando sufre oxidación. Otros aceptores de electrones pueden cumplir la misma función cuando el oxígeno no está disponible, pero ninguno produce casi tanta energía libre. Por ejemplo, si no se puede suministrar oxígeno a las células musculares de mamíferos tan rápido como sea necesario, cambian a un proceso anaeróbico que produce ácido láctico en lugar de CO 2:
\[\ce{C6H12O6 + 2 ADP → 2 CH3CH(OH)COOH} \quad ΔG^o = –218\, kJ\, mol^{–1} \label{6-4}\]
En este proceso, solo se captura (2 × 30 kJ) = 60 kJ de energía libre, por lo que la eficiencia es de solo 28% sobre la base de esta reacción, y es aún menor en relación con la glucosa. En el ejercicio “aeróbico”, se intenta mantener la capacidad pulmonar y el gasto cardíaco suficientes para suministrar oxígeno a las células musculares a un ritmo que promueva la vía aeróbica.
La respiración y muchos otros procesos metabólicos implican reacciones de transferencia de electrones.
Reacciones ácido-base: la caída del protón
Según el concepto ampliamente útil de Brønsted-Lowry, un ácido es un donante de protones y una base es un aceptor de protones. En 1953, Gurney mostró cómo esta idea podría ser aún más útil colocando pares de conjugados ácido-base en una escala de energía libre de protones.
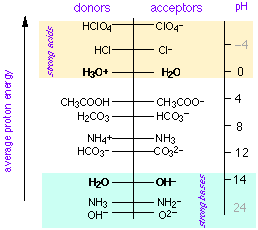
En esta visión, los ácidos son fuentes de protones y las bases son sumideros de protones. Los protones caen espontáneamente de los ácidos para llenar sumideros en los que los niveles de energía libre de protones son menores. El pH es una medida de la energía promedio libre de protones en la solución; cuando esta cantidad es la misma que el nivel de energía libre de protones de un par conjugado, las dos especies están presentes en concentraciones iguales (esto corresponde, por supuesto, a la igualdad de pH y pK a en la teoría convencional).
El concepto de energía libre de protones se emplea comúnmente en la química ambiental acuática en la que se deben tratar múltiples sistemas ácido-base sobre bases semicuantitativas. Está, sin embargo, admirablemente adaptada a cualquier presentación de la química ácido-base, incluso en el nivel universitario de primer año, y parece una pena que nunca pareciera haberse abierto paso en el plan de estudios ordinario.
Oxidación-reducción: la caída del electrón
Las reacciones de oxidación-reducción proceden en una dirección que permite que el electrón “caiga” (en energía libre) de una “fuente” a un “sumidero”. Posteriormente cuando estudies electroquímica verás cómo esta energía libre puede manifestarse como una tensión eléctrica y ser extraída del sistema como trabajo eléctrico.
Niveles de energía libre de electrones y la serie electromotriz
Es posible que ya hayas visto una tabla de fuerza electromotriz que muestra las tendencias relativas de diferentes agentes reductores para donar electrones. La misma información se puede presentar de otra manera que relaciona la potencia donadora de electrones (reductora) con la “caída” de la energía libre que sufren los electrones cuando son transferidos a un agente oxidante.
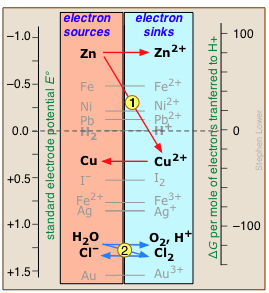
Cualquier sumidero disponible en el lado derecho tenderá a drenar electrones de una fuente por encima de él. Por ejemplo, la inmersión de zinc metálico en una solución de CuSO 4 permite que los electrones “caigan” de la alta energía libre que poseen en Zn hasta el menor nivel de energía libre en los iones Cu 2 + recién introducidos. Esto dará como resultado la reducción de Cu 2 + a cobre metálico y la oxidación del zinc (flechas rojas.)
De igual manera, la adición de cloro al agua introducirá un nuevo disipador de electrones (Cl 2) que se encuentra por debajo de la energía libre de los electrones accesibles en H 2 O, drenándolos y produciendo O 2 y Cl — (flechas azules.) Obsérvese especialmente las posiciones de los pares H 2/H + y H 2 O/O 2, H + en esta tabla, ya que definen el rango de E °s para sustancias que no descompondrán el agua. El cero para G° se establece arbitrariamente a la actividad electrónica a la que el par H 2 /H + se encuentra en equilibrio; esto corresponde a E° = 0 voltios en la escala electromotriz ordinaria.
Las reacciones redox acopladas son fundamentales para la bioenergética

\[\{CH_2O\} → CO_2 + H_2O \label{6-5}\]
En el gráfico anterior, el cero para G° se establece arbitrariamente a la energía libre de electrones requerida para mantener el par H 2 /H + está en equilibrio; esto corresponde a E° = 0 voltios en la escala electromotriz ordinaria.
Los organismos que viven en ambientes donde falta oxígeno, como marismas, suelos fangosos y los tractos intestinales de los animales, deben utilizar otros aceptores de electrones para extraer energía libre de carbohidratos. Una amplia variedad de iones inorgánicos como sulfato y nitrato, así como otros compuestos de carbono pueden servir como aceptores de electrones, produciendo los productos gaseosos como H 2 S, NH 3 y CH 4 que comúnmente se notan en tales ubicaciones. A partir de la ubicación de estos aceptores en la escala, es evidente que la cantidad de energía que pueden extraer de una cantidad dada de carbohidratos es mucho menor que para O 2. Una razón por la que los organismos aeróbicos han dominado la tierra se cree que es la eficiencia energética mucho mayor del oxígeno como aceptor de electrones.
¿Qué usaban los organismos como alimento antes de que hubiera un suministro generalizado de carbohidratos en el mundo? Cualquiera de las fuentes de electrones cercanas a la parte superior izquierda de la tabla puede, en teoría, cumplir esta función, aunque con una eficiencia energética reducida. De hecho, todavía hay una serie de estas bacterias autótrofas alrededor cuyo “alimento” es CH 4, CH 3 OH, FeCo 3, ¡e incluso H 2!
Termodinámica de Bandas de Goma
El caucho está compuesto por cadenas de longitud aleatoria de moléculas de isopreno polimerizadas. Las cadenas de poli (isopreno) se mantienen unidas en parte por fuerzas intermoleculares débiles, pero se unen a intervalos irregulares mediante enlaces disulfuro covalentes para formar una red. Las fuerzas intermoleculares entre los fragmentos de cadena tienden a enrollarlos, pero la aplicación de una fuerza de tracción puede hacer que se alarguen. Las reticulaciones disulfuro evitan que las cadenas se deslicen entre sí, manteniendo así la integridad física del material. Sin esta reticulación, las cadenas poliméricas se comportarían más como un montón de espaguetis.
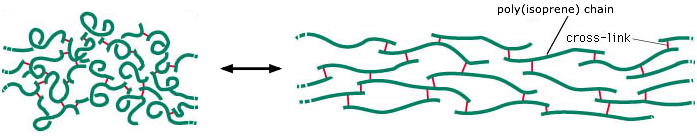
La capacidad de las bandas de goma y otras sustancias elásticas para sufrir un cambio en las dimensiones físicas en respuesta a un cambio en la fuerza de estiramiento aplicada está sujeta a las mismas leyes de termodinámica que cualquier otro proceso físico. Puedes investigar esto por ti mismo.
Sostenga una banda de goma (cuanto más gruesa, mejor) contra su labio superior, y observe cómo cambia la temperatura cuando se estira la banda, y luego nuevamente cuando se le permite contraerse.
- Utilizar los resultados de esta observación para determinar los signos de Δ H, Δ G y Δ S para el proceso\[rubber_{stretched} \rightarrow rubber_{unstretched}\]
- ¿Cómo se cambiará la tendencia de la goma estirada a contraerse si se eleva la temperatura?
Solución
- La contracción es obviamente un proceso espontáneo, por lo que Δ G es negativo. Habrás observado que el calor se desprende cuando se estira la banda, lo que significa que la contracción es endotérmica, por lo que Δ H > 0. Así, de acuerdo con Δ G = Δ H — TΔ S, Δ S para el proceso de contracción debe ser positivo.
- Debido a que Δ S > 0, la contracción del caucho se vuelve más espontánea a medida que aumenta la temperatura.
¿Por qué es Goma Elástica?
Cuando un material ordinario se pone bajo tensión, la energía de deformación es absorbida por las distorsiones del enlace y se almacena como energía potencial electrostática que aumenta muy rápidamente para inhibir en gran medida el alargamiento adicional. En los polímeros similares al caucho, esto no sucede; la energía de deformación se almacena en cambio como energía térmica (cinética).
Las cadenas de polímeros libres tienden naturalmente a acurrucarse de formas complejas y en constante cambio, ya que la energía térmica permite que se produzcan rotaciones de enlaces aleatorios. En un material similar al caucho en su estado relajado, las porciones de las cadenas de polímero entre reticulaciones están continuamente saltando entre diferentes configuraciones enrolladas al azar.

Cuando se estira el caucho, los segmentos de polímero se enderezan a medida que la fuerza aplicada supera las interacciones débiles de la fuerza de dispersión que causaron que las hebras se rizaran. Cada segmento de cadena se estira en una conformación casi recta, lo que reduce en gran medida la cantidad de energía térmica que puede almacenar. El exceso de energía térmica se esparce en el material y se pierde en forma de calor. Cuando el caucho se relaja, las hebras de polímero se acurrucan nuevamente y absorben la energía térmica.
La contracción espontánea del caucho es en gran parte un proceso impulsado por entropía. El número de formas energéticamente equivalentes de distribuir energía térmica entre las cadenas poliméricas casi lineales del estado estirado del caucho es insignificante en comparación con las disponibles cuando las cadenas se enrollan de manera aleatoria, por lo que la forma no estirada del caucho es estadísticamente la más probable por probabilidades abrumadoras. Como se señaló en la parte (b) del ejemplo de problema anterior, la ganancia en entropía cuando el caucho se contrae impulsa Δ G más negativo a temperaturas más altas. Esto significa que una banda de goma, mantenida a tensión constante en estado estirado, se contraerá cuando se caliente.

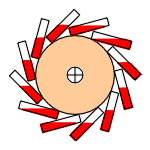
Este hecho se puede poner en uso de una manera interesante. Reemplace los radios de una rueda de bicicleta con bandas de goma y encienda una lámpara de calor en un lado de la rueda. La contracción de las bandas calentadas desplazará la rueda descentrada, haciendo que gire. Esta rotación continuará indefinidamente mientras la fuente de calor esté presente. ¡El dispositivo se ha convertido en un motor térmico cuyo “fluido” de trabajo es el caucho!
Esto recuerda el diseño clásico de la máquina de movimiento perpetuo en el que una rueda es obligada a girar por pesos desequilibrados que cambian continuamente (la que aquí se representa usa viales articulados de mercurio). Eso, como vimos, violaría la Segunda Ley al producir trabajo en un proceso cíclico sin degradar el calor a una temperatura más baja. El motor térmico de banda de goma evita este escollo al absorber calor de una fuente externa en un lado de la rueda y liberarlo a una temperatura más baja en el lado sin calentar.


