2.3.1: Alimentos- Dietas Elementales
- Page ID
- 74855
La teoría atómica en los alimentos
Introducción: Minerales, Elementos y Compuestos
Los libros de nutrición suelen ser confusos cuando discuten los requisitos de nutrientes humanos. Por ejemplo, uno, al discutir los minerales esenciales en la nutrición deportiva [1] dice “Los minerales son elementos”. Pero solo un mineral esencial común, el hierro (simbolizado Fe para el latín “Ferrum”) es comúnmente ingerido como elemento. El hierro es un elemento porque está conformado por un solo tipo de átomo, designado por el símbolo Fe. Otros símbolos se dan en la Tabla siguiente. Las partículas de metal de hierro se encuentran realmente en los cereales para el desayuno [2], y la forma más fácil de demostrarlo es flotar un copo de cereal en el agua y jalarlo con un imán. También se puede ver extraído en varios videos de YouTube como este. En ocasiones se agrega hierro como compuesto, como “sulfato ferroso”, FeSO 4. Un compuesto tiene átomos de varios elementos unidos entre sí es proporciones específicas. Las proporciones vienen dadas por los subíndices en la fórmula; en este caso, el sulfato ferroso se elabora a partir de 1 átomo de hierro, 1 del elemento azufre y 4 átomos del elemento oxígeno.
Otro mineral esencial que suele identificarse mal es el “yodo”. El nutriente que realmente ingerimos no es el elemento yodo, sino un compuesto de yodo como el yoduro de potasio, KI (K es el símbolo del potasio, después del Kallium alemán).
Si bien el KI mineral se ve y sabe a sal de mesa, el elemento yodo es un sólido de color púrpura oscuro (casi negro), a veces disuelto en alcohol para dar una solución marrón utilizada para desinfectar heridas menores. Es un elemento tóxico con la fórmula I 2<, mostrando que un elemento puede estar formado por moléculas que contienen dos o más átomos unidos entre sí, siempre y cuando los átomos sean iguales.


Cuando los cristales de yodo se calientan, se “subliman” (se convierten directamente en un gas) para dar vapores morados compuestos por moléculas diatómicas. La fase líquida, que también contiene moléculas diatómicas, solo se forma bajo presión superior a la atmosférica. Todas las fases son el elemento yodo, porque contienen solo I átomos. (Ver Bromo como ejemplo)
Otros minerales esenciales son referidos como “elementos”, pero en realidad son tóxicos o inútiles para nuestro cuerpo como elementos. Los alimentos deben contener nutrientes en compuestos químicos que sean fácilmente digeridos y absorbidos en nuestros cuerpos para que sean nutritivos. Por ejemplo, el elemento fósforo puede tener varias formas. Uno, P 4, es muy tóxico y en realidad se quema cuando se expone al aire, haciendo un brillo que es responsable de su nombre.

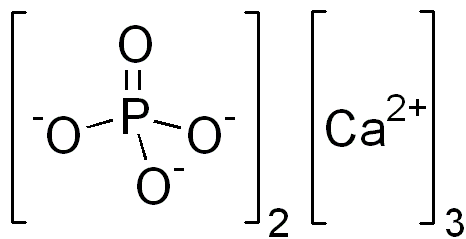
La forma nutritiva del fósforo se ilustra con fosfatos minerales, como Ca 3 (PO 4) 2, que contiene 3 átomos de calcio (veremos más adelante, están en forma de “iones” cada uno con una carga 2+, Ca 2 +) y 2 “iones fosfato”, cada uno hecho de 1 átomo de fósforo unido a 4 átomos de oxígeno, y que tiene una carga total de 3. El fósforo también se suministra en biomoléculas que se encuentran en carnes y verduras.
“Dietas elementales”
Una “dieta elemental” es una solución de nutrientes que se puede administrar por vía intravenosa (o con sonda de alimentación gástrica) para personas con trastornos digestivos, como la enfermedad de Crohn o la colitis. No hay elementos en una dieta elemental, sino los compuestos químicos más simples que pueden proporcionar una nutrición completa (o casi completa). Una dieta elemental típica nos muestra lo que se requiere para mantener nuestros cuerpos. [3] Requerimos onzas a libras de macronutrientes diarios, pero normalmente menos de 5 g (.2 oz) de micronutrientes.
- Macronutrientes (necesarios para la energía y construcción de partes del cuerpo)
- Carbohidratos: Sólidos de jarabe de maíz, mono y diglicéridos, ésteres de mono y diglicéridos
- Lípidos Esenciales: Aceite de Coco Fraccionado, Aceite de Canola, Aceite de Cártamo Alto Oleico
- Aminoácidos: (L-glutamina), L-isoleucina, L-leucina, L-lisina-L-aspartato, N-acetil-L-metionina, L-fenilalanina, L-treonina, (L-prolina), L-triptófano, (glicina), L-histidina, L-arginina, L-valina, (L-alanina), (L-serina), (L-tirosina), (L-cistina), (taurina, un ácido sulfónico).
- Micronutrientes (utilizados principalmente en reguladores de procesos corporales)
- Minerales: Citrato Tripotásico, Fosfato Tricálcico, Fosfato Dicálcico, Cloruro de Sodio, Acetato de Magnesio, Sulfato Ferroso, Sulfato de Zinc, Sulfato de Manganeso, Sulfato Cúprico, Yoduro de Potasio, Cloruro de Cromo, Molibdato de Sodio, Selenito de Sodio
- Vitaminas: Bitartrato de Colina (B), (M-Inositol), Niacinamida (B3), D-Pantotenato de Calcio (B6), Clorhidrato de Cloruro de Tiamina (B1), Clorhidrato de Piridoxina (B6), Riboflavina (B2), Ácido Fólico (B9), Cianocobalamina (B12), D-Biotina (D7), Vitamina D3, Ácido L-Ascorbico (C), Acetato de DL-alfa tocoferol (E), vitamina A Acetato, Filoquinona (K1).
- Otros
- Suplemento Nutricional: L-Carnitina (normalmente sintetizada a partir de aminoácidos).
- Emulsionante, espesantes: Ácido Diacetil Tartárico, Alginato de Propilenglicol.
La relación de elementos químicos en nuestro cuerpo a veces se presenta como una “fórmula para un ser humano”, que no representa ningún compuesto químico real, sino que solo nos dice los números relativos de átomos:
\[\ce{H_{375,000,000}O_{132,000,000}C_{85,700,000}N_{6,430,000}Ca_{1,500,000}P_{1,020,000}S_{206,000}Na_{183,000}K_{177,000}Cl_{127,000}Mg_{40,000}Si_{38, 600}Fe_{2,680}Zn_{2,110}Cu_{76}I_{14}Mn_{13}F_{13}Cr_{7}Se_{4}Mo_{3}Co_{1}} \nonumber \]
Entonces, por solo 1 átomo de cobalto (Co), necesitamos 2,680 átomos de hierro, 1,500,000 átomos de calcio (Ca), etc. Claramente, hay mucho que la química nos puede decir sobre la nutrición. Pero, ¿cómo sabemos qué es un “elemento” y qué es un “compuesto”, y qué compuestos proporcionan los elementos que necesitamos para mantener nuestros cuerpos?
¿Cómo sabemos qué sustancias contienen elementos esenciales?
Los primeros filósofos griegos (Empédocles, Lucrecio y Demócrito) propusieron que todo estaba hecho de átomos, pero no tenían forma de aportar pruebas para la afirmación. Evidencia de que cada elemento químico está compuesto por un tipo de átomo (que no se modifica durante las reacciones químicas) finalmente se desarrolló entre 1750 y 1850. Mirar las imágenes de yoduro de potasio (KI) y yodo (I 2) anteriores, ayudará a imaginar lo inverosímil que debió haber parecido que compartan un átomo de yodo común.
La evidencia de átomos inmutables como componentes de elementos provino de mediciones de peso. Joseph Priestley y Antoine Lavoisier finalmente interpretaron correctamente la pérdida de peso cuando algunas sustancias se queman (madera o azúcar) y el aumento de peso de otras, al reconocer que la masa de átomos en los gases había sido descuidada. Lavoisier demostró que el mercurio (Hg) gana peso porque se combina con moléculas de oxígeno del aire para hacer óxido mercúrico sólido:
\[\ce{2 Hg + O2 → 2 HgO.} \nonumber \]
Pero la madera pierde peso porque se convierte en moléculas gaseosas de dióxido de carbono y agua de igual masa. La reacción de combustión es similar a la combustión del azúcar, la glucosa, que es la base del metabolismo de los carbohidratos en nuestros cuerpos para aportar energía:
\[\ce{C6H12O6 + 6 O2 → 6 CO2 + 6 H2O} \nonumber \]
Anteriormente, van Helmont [5] no había logrado reconocer que la incorporación de gas dióxido de carbono contribuyó más al aumento de peso de los árboles; pensó que era el agua, porque el suelo prácticamente no mostró ningún cambio de masa. Sin embargo, mostró compromiso con la idea de concervación de masas, que ninguna masa debe perderse ni ganarse durante un cambio químico. La ecuación para la fotosíntesis es solo la inversa de la ecuación de combustión anterior,
\ [\ begin {alinear*}\ ce {6 CO2} +\ ce {6 H2O} &\ fila derecha\ ce {C6H12O6} +\ ce {6 O2}\\ [4pt]
\ texto {dióxido de carbono} +\ texto {agua} +\ texto {energía lumínica} &\ fila derecha\ texto {carbohidrato} +\ texto {oxígeno}\ end {alinear*}\ nonumber\]
así podríamos decir que los árboles son en su mayoría carbohidratos, y que cuando se queman, liberan la energía que habían absorbido del sol mientras crecían:
Mientras Lavoisier continuaba sus experimentos con el oxígeno, se percató de otra cosa. Aunque el oxígeno se combinó con muchas otras sustancias, nunca se comportó como si fuera en sí una combinación de otras sustancias. Lavoisier pudo descomponer el calx rojo en mercurio y oxígeno, pero no pudo encontrar forma de descomponer el oxígeno en dos o más sustancias nuevas. Debido a esto, sugirió que el oxígeno debe ser un elemento, una sustancia en última instancia simple que no puede ser descompuesta por cambios químicos.
Este fue el descubrimiento fundamental que nos permite identificar el fosfato tricálcico como una buena fuente de “fósforo” o el yoduro de potasio como buena fuente de “yodo”.
John Dalton [1] (1766 a 1844) era una generación más joven que Lavoisier y diferente a él en casi todos los aspectos. Dalton provenía de una familia de clase trabajadora y solo asistía a la escuela primaria. Aparte de esto, fue completamente autodidacta. Incluso después de hacerse famoso, nunca aspiró más allá de una modesta existencia de licenciatura en la que se sustentó enseñando matemáticas a alumnos particulares. Dalton hizo muchas contribuciones a la ciencia, y parece no haberse dado cuenta de que su teoría atómica era la más importante de ellas. En su “Nuevo Sistema de Filosofía Química” publicado en 1808, ¡solo se le dedican las últimas siete páginas de un total de 168!
Referencias
- Driskell, J.A. “Nutrición Deportiva”, CRC Press, Boca Raton, FL,2000, p. 85
- Quimsta [www.chymist.com]
- www.neocate.com/aaa_neocate/6... gredients.html
- Sterner, R.W. y J.J. Elser, “Estequiometría ecológica: La biolgia de los elementos de las moléculas a la biosfera”, Princeton University Press, Princeton, NJ, 2002, p. 3
- es.wikipedia.org/wiki/Van_Helmont


