2.3: La teoría atómica
- Page ID
- 74845
El desarrollo de la teoría atómica debe mucho al trabajo de dos hombres: Antoine Lavoisier, quien no pensó en la materia en términos de átomos pero cuyo trabajo sentó las bases de organización para pensar en elementos, y John Dalton, a quien se le atribuye la teoría atómica. Gran parte del trabajo de Lavoisier como químico se dedicó al estudio de la combustión. Se convenció de que cuando una sustancia se quema en el aire, se combina con algún componente del aire. Finalmente se dio cuenta de que este componente era el aire desflogisticado que había sido descubierto por José Sacerdotal (1733 a 1804) unos años antes. Lavoisier cambió el nombre de esta sustancia oxígeno. En una importante serie de experimentos demostró que cuando el mercurio se calienta en oxígeno a una temperatura moderada, se obtiene una sustancia roja, calx de mercurio. (Un calx es la ceniza que queda cuando una sustancia se quema en el aire.) A mayor temperatura este calx se descompone en mercurio y oxígeno. Los cuidadosos experimentos de Lavoisier también revelaron que las masas combinadas de mercurio y oxígeno eran exactamente iguales a la masa de calx de mercurio. Es decir, no hubo cambio en la masa tras la formación o descomposición del calx. Lavoisier planteó la hipótesis de que esto debería ser cierto para todos los cambios químicos, y otros experimentos demostraron que tenía razón. Este principio se llama ahora la ley de conservación de la masa.
Mientras Lavoisier continuaba sus experimentos con el oxígeno, se percató de otra cosa. A pesar de que el oxígeno se combinó con muchas otras sustancias, nunca se comportó como si fuera en sí una combinación de otras sustancias. Lavoisier pudo descomponer el calx rojo en mercurio y oxígeno, pero no pudo encontrar la manera de descomponer el oxígeno en dos o más sustancias nuevas. Debido a esto, sugirió que el oxígeno debe ser un elemento, una sustancia en última instancia simple que no puede ser descompuesta por cambios químicos.
Lavoisier no originó la idea de que ciertas sustancias (elementos) fueran fundamentales y todas las demás pudieran derivarse de ellas. Esto había sido propuesto por primera vez en Grecia durante el siglo V a.C. por Empedocles, quien especuló que toda la materia consistía en combinaciones de tierra, aire, fuego y agua. Estas ideas fueron desarrolladas y enseñadas por Aristóteles y permanecieron influyentes durante 2000 años.
Lavoisier sí produjo la primera tabla de los elementos que contenían un gran número de sustancias que los químicos modernos estarían de acuerdo en que deberían ser clasificados como elementos. Lo publicó con el conocimiento de que más investigaciones podrían tener éxito descomponiendo algunas de las sustancias enumeradas, demostrando así que no son elementos. Uno de sus objetivos era incitar a sus contemporáneos en ese tipo de investigación. Por cierto, las “sustancias terrestres” enumeradas en la parte inferior finalmente se demostró que eran combinaciones de ciertos metales con oxígeno. También es interesante señalar que ni siquiera Lavoisier pudo escapar por completo de la influencia de Aristóteles. El segundo elemento de su lista es el “fuego” de Aristóteles, que Lavoisier llamó “calórico”, y que ahora llamamos “calor”. Tanto el calor como la luz, los dos primeros elementos de la tabla, se consideran ahora como formas de energía más que de materia.
Si bien su tabla de elementos estaba incompleta, e incluso incorrecta en algunos casos, la obra de Lavoisier representó un gran paso adelante. Al clasificar ciertas sustancias como elementos, estimuló mucha investigación química adicional y aportó orden y estructura al tema donde ninguna había existido antes. Sus contemporáneos aceptaron muy fácilmente sus ideas, y se hizo conocido como el padre de la química.
John Dalton (1766 a 1844) era una generación más joven que Lavoisier y diferente a él en casi todos los aspectos. Dalton provenía de una familia de clase trabajadora y solo asistía a la escuela primaria. Aparte de esto, fue completamente autodidacta. Incluso después de hacerse famoso, nunca aspiró más allá de una modesta existencia de licenciatura en la que se sustentó enseñando matemáticas a alumnos particulares. Dalton hizo muchas contribuciones a la ciencia, y parece no haberse dado cuenta de que su teoría atómica era la más importante de ellas. En su “Nuevo Sistema de Filosofía Química” publicado en 1808, ¡solo se le dedican las últimas siete páginas de un total de 168!
A continuación se dan los postulados de la teoría atómica. El primero no es un avance sobre el antiguo filósofo griego Demócrito que había teorizado casi 2000 años antes que la materia consiste en partículas muy pequeñas.
- Toda la materia está compuesta por un número muy grande de partículas muy pequeñas llamadas átomos.
- Para un elemento dado, todos los átomos son idénticos en todos los aspectos. En particular todos los átomos del mismo elemento tienen la misma masa constante, mientras que los átomos de diferentes elementos tienen diferentes masas.
- Los átomos son las unidades de los cambios químicos. Las reacciones químicas implican la combinación, separación o reordenamiento de átomos, pero los átomos no son creados, destruidos, divididos en partes o convertidos en átomos de cualquier otro tipo.
- Los átomos se combinan para formar moléculas en proporciones fijas de números enteros pequeños.
El segundo postulado, sin embargo, muestra la marca de un genio original; aquí Dalton vincula la idea de átomo con la idea de elemento. El criterio de Lavoisier para un elemento había sido esencialmente macroscópico, experimental. Si una sustancia no podía descomponerse químicamente, entonces probablemente era un elemento. Por el contrario, Dalton define un elemento en términos teóricos, submicroscópicos. Un elemento es un elemento porque todos sus átomos son iguales. Diferentes elementos tienen diferentes átomos. Hay tantos tipos diferentes de elementos como diferentes tipos de átomos.
Ahora mire hacia atrás un momento a los estados físicos del mercurio, donde se dieron imágenes submicroscópicas de mercurio sólido, líquido y gaseoso. Aplicando el segundo postulado de Dalton a esta figura, se puede concluir de inmediato que el mercurio es un elemento, porque sólo aparece un tipo de átomo. Si bien los átomos de mercurio se dibujan como esferas en la figura, hoy en día sería más común representarlos usando símbolos químicos. El símbolo químico de un elemento (o un átomo de ese elemento) es una abreviatura de una o dos letras de su nombre. Por lo general, pero no siempre, se utilizan las dos primeras letras. Para complicar aún más las cosas, los símbolos químicos a veces se derivan de un idioma que no es el inglés. Por ejemplo, el símbolo de Hg para mercurio proviene de la primera y séptima letras del nombre latino del elemento, hidrargiro.
| Nombre | Símbolo | Número atómico | Peso atómico | Nombre | Símbolo | Número atómico | Peso atómico |
|---|---|---|---|---|---|---|---|
| Actinium 2 | Ac | 89 | (227) | Molibdeno | Mo | 42 | 95.96 (2) |
| Aluminio | Al | 13 | 26.981 5386 (8) | Neodimio | Nd | 60 | 144.242 (3) |
| Americio 2 | Am | 95 | (243) | Neón | Ne | 10 | 20.1797 (6) |
| Antimonio | Sb | 51 | 121.760 (1) | Neptunio 2 | Np | 93 | (237) |
| Argón | Ar | 18 | 39.948 (1) | Níquel | Ni | 28 | 58.6934 (4) |
| Arsénico | Como | 33 | 74.92160 (2) | Niobio | Nb | 41 | 92.90638 (2) |
| Astadino 2 | En | 85 | (210) | Nitrógeno | N | 7 | 14.0067 (2) |
| Bario | Ba | 56 | 137.327 (7) | Nobelio 2 | No | 102 | (259) |
| Berkelio 2 | Bk | 97 | (247) | Osmio | Os | 76 | 190.23 (3) |
| Berilio | Be | 4 | 9.012182 (3) | Oxígeno | O | 8 | 15.9994 (3) |
| Bismuto | Bi | 83 | 208.98040 (1) | Palladium | Pd | 46 | 106.42 (1) |
| Bohrium | Bh | 107 | (272) | Fosforo | P | 15 | 30.973762 (2) |
| Boro | B | 5 | 10.811 (7) | Platino | Pt | 78 | 195.084 (9) |
| Bromo | Br | 35 | 79.904 (1) | Plutonio 2 | Pu | 94 | (244) |
| Cadmio | Cd | 48 | 112.411 (8) | Polonio 2 | Po | 84 | (209) |
| Calcio | Ca | 20 | 40.078 (4) | Potasio | K | 19 | 39.0983 (1) |
| Californio 2 | Cf | 98 | (251) | Praseodimio | Pr | 59 | 140.90765 (2) |
| Carbono | C | 6 | 12.0107 (8) | Prometio 2 | Pm | 61 | (145) |
| Cerio | Ce | 58 | 140.116 (1) | Protactinio 2 | Pa | 91 | 231.03588 (2) |
| Cesio | Cs | 55 | 132.9054519 (2) | Radio 2 | Ra | 88 | (226) |
| Cloro | Cl | 17 | 35.453 (2) | Radón 2 | Rn | 86 | (222) |
| Cromo | Cr | 24 | 51.9961 (6) | Renio | Re | 75 | 186.207 (1) |
| Cobalto | Co | 27 | 58.933195 (5) | Rhodium | Rh | 45 | 102.90550 (2) |
| Cobre | Cu | 29 | 63.546 (3) | Roentgenium 2 | Rg | 111 | (280) |
| Curio 2 | Cm | 96 | (247) | Rubidio | Rb | 37 | 85.4678 (3) |
| Darmstadtium 2 | Ds | 110 | (281) | Rutenio | Ru | 44 | 101.07 (2) |
| Dubnium 2 | Db | 105 | (268) | Rutherfordium 2 | Rf | 104 | (267) |
| Disprosio | Dy | 66 | 162.500 (1) | Samario | Sm | 62 | 150.36 (2) |
| Einsteinium 2 | Es | 99 | (252) | Scandium | Sc | 21 | 44.955912 (6) |
| Erbio | Er | 68 | 167.259 (3) | Seaborgium 2 | Sg | 106 | (271) |
| Europio | Eu | 63 | 151.964 (1) | Selenio | Se | 34 | 78.96 (3) |
| Fermio 2 | Fm | 100 | (257) | Silicio | Si | 14 | 28.0855 (3) |
| Flúor | F | 9 | 18.9984032 (5) | Plata | Ag | 47 | 107.8682 (2) |
| Francium 2 | Fr | 87 | (223) | Sodio | Na | 11 | 22.98976928 (2) |
| Gadolinio | Gd | 64 | 157.25 (3) | Estroncio | Sr | 38 | 87.62 (1) |
| Galio | Ga | 31 | 69.723 (1) | Azufre | S | 16 | 32.065 (5) |
| Germanio | Ge | 32 | 72.64 (1) | Tantalio | Ta | 73 | 180.94788 (2) |
| Oro | Au | 79 | 196.966569 (4) | Tecnecio 2 | Tc | 43 | (98) |
| Hafnio | Hf | 72 | 178.49 (2) | Telurio | Te | 52 | 127.60 (3) |
| Hassium 2 | Hs | 108 | (277) | Terbio | Tb | 65 | 158.92535 (2) |
| Helio | Él | 2 | 4.002602 (2) | Talio | Tl | 81 | 204.3833 (2) |
| Holmio | Ho | 67 | 164.93032 (2) | Torio 2 | Th | 90 | 232.03806 (2) |
| Hidrógeno | H | 1 | 1.00794 (7) | Tulio | Tm | 69 | 168.93421 (2) |
| Indio | En | 49 | 114.818 (3) | Estaño | Sn | 50 | 118.710 (7) |
| Yodo | I | 53 | 126.90447 (3) | Titanio | Ti | 22 | 47.867 (1) |
| Iridio | Ir | 49 | 192.217 (3) | Tungsteno | W | 74 | 183.84 (1) |
| Hierro | Fe | 26 | 55.845 (2) | Uranio 2 | U | 92 | 238.02891 (3) |
| Criptón | Kr | 36 | 83.798 (2) | Vanadio | V | 23 | 50.9415 (1) |
| Lantano | La | 57 | 138.90547 (7) | Xenon | Xe | 54 | 131.293 (6) |
| Lawrencium 2 | Lr | 103 | (262) | Iterbio | Yb | 70 | 173.054 (5) |
| Plomo | Pb | 82 | 207.2 (1) | Itrio | Y | 39 | 88.90585 (2) |
| Litio | Li | 3 | [6.941 (2)] 1 | Zinc | Zn | 30 | 65.38 (2) |
| Lutecio | Lu | 71 | 174.9668 (1) | Circonio | Zr | 40 | 91.224 (2) |
| Magnesio | Mg | 12 | 24.3050 (6) | - 2,3,4 | 112 | (285) | |
| Manganeso | Mn | 25 | 54.938045 (5) | - 2,3 | 113 | (284) | |
| Meitnerio 2 | Mt | 109 | (276) | - 2,3 | 114 | (287) | |
| Mendelevio 2 | Md | 101 | (258) | - 2,3 | 115 | (288) | |
| Mercurio | Hg | 80 | 200.59 (2) | - 2,3 | 116 | (293) | |
| - 2,3 | 118 | (294) |
Los símbolos químicos para todos los elementos actualmente conocidos se enumeran anteriormente en la tabla, que también incluye pesos atómicos. Estos símbolos son el vocabulario básico de la química porque los átomos que representan conforman toda la materia. Verás símbolos para los elementos más importantes una y otra vez, y cuanto antes sepas qué elemento representan, más fácil te resultará aprender química. Estos elementos más importantes han sido señalados en la tabla anterior mediante el sombreado coloreado alrededor de sus nombres.
El cuarto postulado de Dalton establece que los átomos pueden combinarse para formar moléculas. Un ejemplo de ello es el bromo, el único elemento distinto del mercurio que es un líquido a temperatura ambiente ordinaria (20°C). Macroscópicamente, el bromo consiste en cristales de color oscuro por debajo de —7.2°C y un gas marrón rojizo por encima de 58.8°C, el líquido es de color marrón rojizo oscuro y tiene un olor acre similar al cloro utilizado en las piscinas. Puede provocar quemaduras graves en la piel humana y no debe manejarse sin la protección de guantes de goma.
 |

|
 |
|---|---|---|
| (a) en estado gaseoso | b) como líquido | c) en forma sólida |
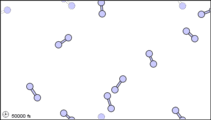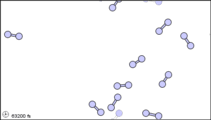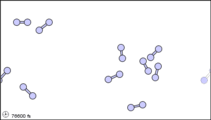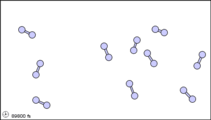
Figura\(\PageIndex{1}\): Vista submicroscópica de las moléculas diatómicas del elemento bromo (a) en estado gaseoso (por encima de 58°C); (b) en forma líquida (entre -7.2 y 58.8°C); y (c) en forma sólida (por debajo de -7,2°C).
La vista submicroscópica del bromo en la siguiente figura concuerda con su designación como elemento, solo hay un tipo de átomo presente. Excepto a temperaturas muy altas, sin embargo, los átomos de bromo siempre se duplican. Ya sea en sólido, líquido o gas, van por pares. Una combinación tan apretada de dos o más átomos se llama molécula.


La composición de una molécula está indicada por una fórmula química. Un subíndice a la derecha del símbolo para cada elemento indica cuántos átomos de ese elemento hay en la molécula. Por ejemplo, la tabla de pesos atómicos da el símbolo químico Br para bromo, pero cada molécula contiene dos átomos de bromo, por lo que la fórmula química es Br 2. Según el cuarto postulado de Dalton, los átomos se combinan en la proporción de números enteros pequeños, por lo que los subíndices en una fórmula deben ser números enteros pequeños.


