3.9: Ley de Hess'
- Page ID
- 76003
Quizás la característica más útil de las ecuaciones termoquímicas es que se pueden combinar para determinar los valores Δ H m para otras reacciones químicas. Consideremos, por ejemplo, la siguiente secuencia de dos pasos. La etapa 1 es la reacción de 1 mol de C (s) y 0,5 mol de O2 (g) para formar 1 mol de CO (g):
\[ \text{C} (s) + \frac{1}{2} \text{O}_{2} (g) \rightarrow \text{C} \text{O} (g) ~~~~~~~~~~~~~~~~~~~~ \Delta H_{m} = –110.5 \text{kJ} = \Delta H_{1} \nonumber \]
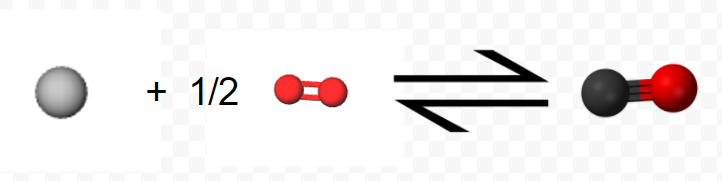
(Obsérvese que dado que la ecuación se refiere a moles, no a moléculas, se permiten coeficientes fraccionarios). En la etapa 2, el mol de CO reacciona con 0,5 moles adicionales de O2 produciendo 1 mol de CO 2:\[ \text{C} \text{O} (g) + \frac{1}{2} \text{O}_{2} (g) \rightarrow \text{C} \text{O}_{2} (g) ~~~~~~~~~~~~~~~~~~~~~~~~~ \Delta H_{m} = –283.0 \text{ kJ} = \Delta H_{2} \nonumber \]
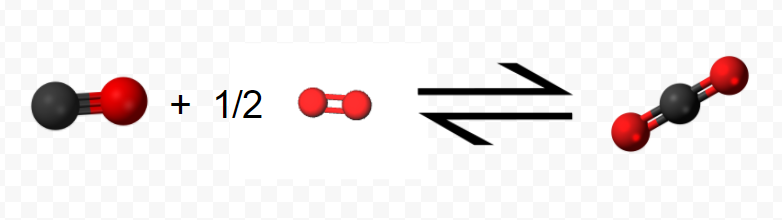
El resultado neto de este proceso en dos etapas es la producción de 1 mol CO 2 a partir del original 1 mol C y 1 mol O 2 (0.5 mol en cada etapa). Todo el CO producido en el paso 1 se agota en el paso 2.
Usando las representaciones moleculares de cada reacción que se muestra arriba, confirme esta conclusión, usando las moléculas para representar visualmente lo que está ocurriendo.
En el papel este resultado neto se puede obtener sumando las dos ecuaciones químicas como si fueran ecuaciones algebraicas. El CO producido es cancelado por el CO consumido ya que es tanto un reactivo como un producto de la reacción global
\[\text{C} (s) + \small\frac{1}{2}\normalsize\text{O}_2 (g) \qquad\quad\quad \space\space\space\rightarrow \cancel{\text{CO} (g)} \qquad \qquad \nonumber \]
\[ \underline{\qquad\quad\space \small\frac{1}{2} \normalsize\text{O}_2 (g) + \cancel{\text{CO} (g)} \rightarrow \qquad \qquad \space\space \text{CO}_2 (g)} \nonumber \]
\[ \text{C}(s) + \space\space\space \text{O}_2 (g) + \cancel{\text{CO} (g)} \rightarrow \cancel{\text{CO} (g)} + \text{CO}_2 (g) \nonumber \]
Experimentalmente se encuentra que el cambio de entalpía para la reacción neta es la suma de los cambios de entalpía para los pasos 1 y 2: Es\[ \Delta H_{net} = –110.5 \text{ kJ} + (–283.0 \text{ kJ} ) = –393.5 \text{ kJ} = \Delta H_{1} + \Delta H_{2} \nonumber \] decir, la ecuación termoquímica\[ \text{C} (s) + \text{ O}_{2} (g) \rightarrow \text{C} \text{O}_{2} (g) \\ \Delta H_{m} = –393.5 \text{ kJ} \nonumber \]
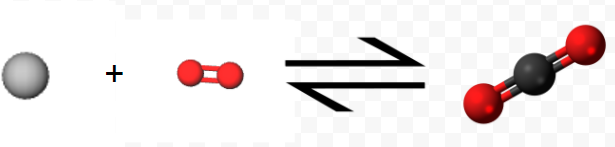

Observe cómo la ecuación anterior representa simbólicamente la reacción, mientras que las moléculas 3D muestran la vista microscópica, y las imágenes finales muestran este proceso tal como lo vemos, a nivel macroscópico.
es la correcta para la reacción general.
En el caso general siempre es cierto que siempre que se puedan agregar dos o más ecuaciones químicas algebraicamente para dar una reacción neta, también se pueden agregar sus cambios de entalpía para dar el cambio de entalpía de la reacción neta.
A este principio se le conoce como ley de Hess'. Si no fuera cierto, sería posible idear una serie de reacciones en las que se crearía energía pero que terminarían con exactamente las mismas sustancias con las que empezamos. Esto contradiría la ley de conservación de la energía. La ley de Hess' nos permite obtener valores Δ H m para reacciones que no pueden llevarse a cabo experimentalmente, como muestra el siguiente ejemplo.
El acetileno (C 2 H 2) no se puede preparar directamente a partir de sus elementos según la ecuación
\[ 2 \text{C} (s) + \text{H}_{2} (g) \rightarrow \text{C}_{2} \text{H}_{2} (g) \tag{1} \]Calcular Δ H m para esta reacción a partir de las siguientes ecuaciones termoquímicas, todas las cuales se pueden determinar experimentalmente:\[ \begin{align} \text{C} (s) &+ \space\space\space\text{O}_{2} (g) \rightarrow \text{C} \text{O}_{2} (g) &\Delta H_{m} &= –393.5 \text{kJ} \tag{2a} \\ \text{H}_{2} (g) &+ \tfrac{1}{2} \text{O}_{2} (g) \rightarrow \text{H}_{2} \text{O} (l) &\Delta H_{m} &= –285.8 \text{kJ} \tag{2b} \\ \text{C}_{2} \text{H}_{2} (g) &+ \tfrac{\text{5}}{\text{2}} \text{O}_{2} (g) \rightarrow 2 \text{C} \text{O}_{2} (g) + \text{H}_{2} \text{O} (l) &\Delta H_{m} &= –1299.8 \text{kJ} \tag{2c} \end{align} \]
Solución: Utilizamos la siguiente estrategia para manipular las tres ecuaciones experimentales de manera que cuando se agregan produzcan la Eq. (1):
a) Dado que la Ec. (1) tiene 2 mol C a la izquierda, multiplicamos la Eq. (2 a) por 2.
b) Dado que la Ec. (1) tiene 1 mol H 2 a la izquierda, dejamos la Eq. (2b) sin cambios.
c) Dado que la Ec. (1) tiene 1 mol C 2 H 2 a la derecha, mientras que hay 1 mol C 2 H 2 a la izquierda de la Ec. (2c) escribimos la Ec. (2c) a la inversa.
Entonces tenemos\[\begin{align} \text{2 C}(s) &+ 2\space\ce{O2}(g) \space\space ~\to~ \ce{2CO2}(g) &\Delta H_{m}&=\text{ 2 (}-\text{393.5) kJ} \\ \ce{H2}(g) &+ \tfrac{1}{2}\space\ce{O2}(g) \space ~\to~ \ce{H2O}(l) &\Delta H_{m} &= -\text{285.8 kJ} \\ \underline{ \ce{2 CO2}(g)} &\underline{\text{ +} \space\space\space\ce{H2O}(l) ~\to~ \ce{C2H2}(g) + \tfrac{5}{2}\ce{O2}(g)} &\Delta H_{m}&=-\text{(}-\text{1299.8 kJ)} \\ \ce{2 C}(s) + \ce{H2}(g) &+ 2\tfrac{1}{2}\ce{O2}(g) ~\to~ \ce{C2H2}(g) +\tfrac{5}{2}\ce{O2}(g) \end{align} \nonumber \]
\[ \begin{align} & \Delta H_{m} = (-787.0 -285.8 + 1299.8) \text{ kJ} \\ & = 227.0 \text{ kJ}\end{align} \nonumber \]
Cancelando 5/2 O 2 en cada lado, el resultado deseado es
\[ 2 \text{C} (s) + \text{H}_{2} (g) \rightarrow \text{C}_{2} \text{H}_{2} (g) ~~~~~~~~~~~~~~~~~~~~~ \Delta H_{m} = 227.0 \text{ kJ} \nonumber \]

