5.8.1: Conexiones culturales- Tonos en un tambor y funciones de onda orbital
- Page ID
- 75547
Un baterista puede influir en el tono de un tambor tocando su superficie. Un tambor vibra de manera complicada, pero todas las vibraciones se pueden descomponer en varios “modos fundamentales” de vibración (ondulaciones), como los que mostramos antes y se explicarán con más detalle a continuación.
Anteriormente sugerimos que las ondas estacionarias bidimensionales en un tambor podrían ayudar a comprender los patrones de onda de los electrones restringidos a un núcleo. Ahora vamos a mostrar cómo funciona eso.
Hay películas reales de las vibraciones de una cabeza de tambor en YouTube, pero las caricaturas a continuación harán que una serie de modos sean fáciles de ver.
Etiquetaremos el primer conjunto de modos m 1,0, m 2,0 y m 3,0, o en general, m n, l. Posteriormente veremos que el primer número corresponde al número de shell, n, o “número cuántico principal” de un átomo, y el segundo al “número cuántico angular”. En este primer conjunto, todos los valores de l (“el”) son 0.

modo m 1,0

modo m 2,0

modo m 3,0
Tenga en cuenta que todos estos vibran hacia arriba y hacia abajo en el medio, aunque los dos últimos tienen nodos circulares donde no vibran en absoluto. Para m 2,0, si comienzas en "3:00 —en el medio del lado derecho, y mueves el puntero del mouse en aproximadamente 7 marcadores de gráfico desde la derecha (aproximadamente 1/3 a 1/2 del camino hacia el centro), encontrarás un nodo, donde no hay vibración. Si un baterista tocara el tambor aquí, no afectaría al segundo modo, pero haría imposible el primer y tercer modo, porque aquí no tienen nodos. El sonido de la batería cambiaría porque se eliminaron dos modos. Tenga en cuenta que el número total de nodos es n-1 (0 para m 1,0, 1 para m 2,0 y 2 para m 3,0). En este caso, todos los nodos son nodos circulares.

modo m 2,1

modo m 3,1

modo m 4,1
Aquí hay otro conjunto de modos vibracionales, m 2,1, m 3,1, m 4,1. Tenga en cuenta que el segundo número, l “el”, ha cambiado de 0 a 1, y nos dice el número de nodos lineales (nodos planos en 3D). Veremos más adelante que l, corresponde al número cuántico angular para los electrones. Puede ser difícil ver estos nodos al principio, pero en modo m 2,1 hay un nodo lineal a lo largo de una diagonal, por lo que la mitad del tambor se desplaza hacia arriba, y la mitad hacia abajo. Los otros modos tienen uno y dos nodos circulares, respectivamente, además del nodo lineal diagonal, debido a que el número total de nodos debe ser n-1.
Por último, el conjunto de modos a continuación tiene l = 2, de manera que hay dos nodos planos, que son dos diagonales, perpendiculares entre sí. Así, el modo m 3,2 divide el tambor en cuatro cuadrantes, con cuadrantes alternos vibrando hacia arriba y hacia abajo, respectivamente. Los otros dos modos tienen nodos circulares adicionales.
|
modo m 3,2 |
modo m 4,2 |
modo m 5,2 |
Ahora veamos las funciones de onda tridimensionales que podrían usarse para describir el electrón, en comparación con las vibraciones del tambor de 3 D. En tres dimensiones, los nodos circulares se convertirán en nodos esféricos, y los nodos lineales se convertirán en nodos planos. También utilizamos una designación taquigráfica para las formas de las funciones de onda, en la que las letras que se utilizan para designar los valores de l:
| l valor | símbolo | término obsoleto/“mnemotécnico” |
| 0 | s | agudo/“esférico” |
| 1 | p | principal/“hélice” |
| 2 | d | difusa/“margarita” (4 lóbulos) o “donut" (d z 2) |
| 3 | f | fundamental/“flor” (8 lóbulos) |
| 4 | g... | y así sucesivamente alfabéticamente |
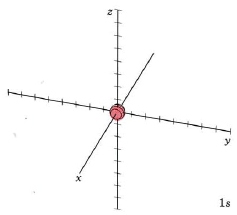
Entonces, si n = 1 y l = 0, es un “orbital 1s”; si n = 3 y l = 2, es un “orbital 3d”, y si n = 4 y l = 3, es un “orbital 4f”, etc. comenzaremos con la función de onda de menor energía, la que tenga menos nodos. Tiene n = 1, l = 0, por lo que se designa “1s”. Mostraremos la vibración del tambor 2D, el orbital 3D como un modelo Jmol giratorio y una “gráfica de superficie” donde se dibuja la superficie para que el electrón esté dentro de ella (típicamente) el 95% del tiempo.
| Designación orbital | Vibración de tambor | Rotación Orbital | Diagrama de superficie de contorno [1] |
| 1 s |
modo m 1,0 |
 |
|
Utilizamos la etiqueta “1 s" para distinguir este patrón de otros patrones de onda que el electrón podría adoptar si se moviera alrededor del núcleo con una mayor energía. Cada uno de estos patrones de onda tridimensionales es diferente en forma, tamaño u orientación de todos los demás y se llama orbital. La palabra orbital se utiliza para hacer una distinción entre estos patrones de onda y las órbitas circulares o elípticas de la imagen de Bohr que se muestra en La naturaleza de onda del electrón.
A temperaturas ordinarias, se encuentra casi invariablemente que el electrón en un átomo de hidrógeno tiene la energía más baja disponible para él. Es decir, el electrón ocupa el orbital de 1 s. La nube de electrones se parece al diagrama de densidad de puntos que se muestra en la Figura 1 de Ondas Electron en el Átomo de Hidrógeno Este orbital se muestra a continuación como un diagrama de superficie límite 1, un diagrama de densidad de puntos 1 y un Jmol giratorio.
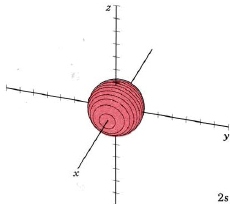
A una temperatura muy alta, sin embargo, algunas colisiones entre los átomos son lo suficientemente duras para proporcionar a uno de los electrones suficiente energía para que pueda ocupar uno de los otros orbitales, digamos un orbital de 2 s, pero esto es inusual. Sin embargo, es necesario conocer estos orbitales de mayor energía, ya que las nubes de electrones que tienen las mismas formas que para el hidrógeno también se aplican a todos los demás átomos en la tabla periódica. A continuación se muestra el orbital de 2 s, nuevamente representado por un diagrama de densidad de puntos, un diagrama de superficie límite y un Jmol giratorio. Observe cómo el diagrama de densidad de puntos revela una característica sobre el orbital de 2 s que la superficie límite no hace: Dado que n = 2 y l = 0, debe haber un nodo “esférico”. Un nodo divide el orbital de 2 s en dos, una porción de la nube de electrones está cerca del centro, mientras que otra porción se encuentra más allá del nodo (la región circular sin puntos). En el nodo la onda no tiene amplitud, su cuadrado también es cero, y hay cero probabilidad de encontrar el electrón. Este nodo adicional da cuenta, en parte, de la mayor energía del orbital 2s.
| Designación orbital | Vibración de tambor | Rotación Orbital | Diagrama de superficie de contorno |
| 2 s |
modo m 2,0 |
 |
|
En el caso de una partícula en una caja unidimensional o vibraciones de tambor, la energía se determinó por un número entero positivo n. La misma situación prevalece en el caso del átomo de hidrógeno. Un entero llamado número cuántico principal, también designado por el símbolo n, se utiliza para etiquetar cada orbital. Cuanto mayor sea el valor de n, mayor será la energía del electrón y mayor será la distancia promedio de la nube de electrones desde el núcleo. En los dos orbitales ya considerados, n = 1 para el orbital de 1 s, n = 2 para el orbital 2s.
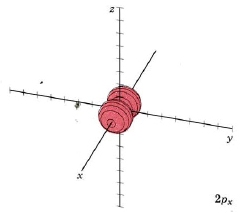
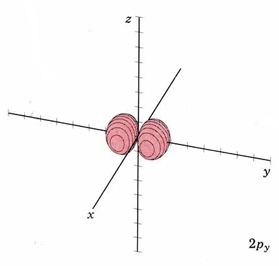
Para el segundo shell, n=2, el número total de nodos es 1, por lo que l puede tener valores de 0 o 1 (ya que puede haber 0 o 1 nodo plano). Si l = 1 obtenemos un nuevo conjunto de orbitales, designamos 2p con un nodo plano. En el átomo H, estos orbitales tienen la misma energía que los orbitales 2s porque tienen el mismo número de nodos, pero cuando se agregan más electrones, tienen diferentes energías. Dado que hay tres planos independientes definidos por geometría 3D (cada rebanado a través del eje x, y o z), debe haber tres orbitales con 1 nodo plano. Se designan 2p x, 2p y y 2p z. Esto es análogo a las vibraciones de tambor 2D, donde hay 2 líneas perpendiculares que definen los nodos. Los diagramas de límites muestran por qué la “hélice” mnemotécnica podría ser apropiada.
| Designación orbital | Vibración de tambor | Rotación Orbital | Diagrama de superficie de contorno | |
| 2 p x |
modo m 2,1 plano nodal yz |
 |
|
|
| 2 p y |
modo m 2,1 plano nodal xz |
 |
|
|
| 2 p z |
modo m 2,1 plano nodal xy |
 |
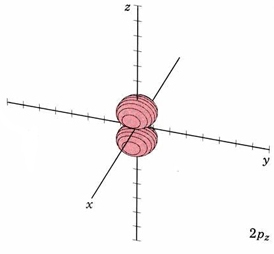
|
Cuando n es igual a 3, hay 2 nodos, y l puede tener valores de 0, 1 o 2 (ya que puede haber 0, 1 o 2 nodos planos). Los dos primeros son familiares, los orbitales s orbitales y p. A continuación se presentan representaciones de los orbitales de 3 s y los orbitales de 3 p. Como la órbita de 2 s fue ligeramente diferente en forma de la orbital de 1 s debido a la introducción de un nodo, por lo que los orbitales de 3 s y 3 p difieren ligeramente en forma de los orbitales de 2 s y 2 p.
| Designación orbital | Vibración de tambor | Diagrama de superficie de contorno |
| 3 s |
modo m 3,0 |
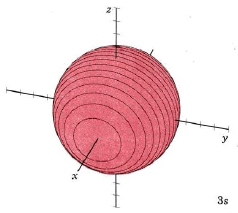
|
| 3 p x |
modo m 3,1 plano nodal yz |
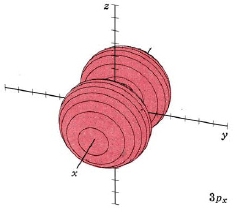
|
| 3 p y | como arriba, plano nodal xz |
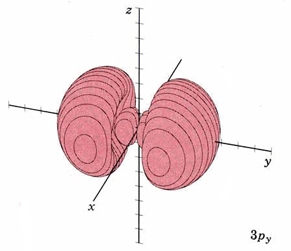
|
| 3 p z | como arriba, plano nodal xy |
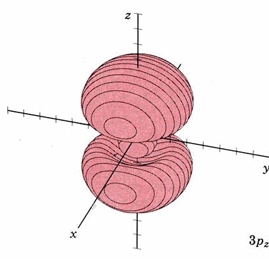
|
En el tercer caparazón hay 2 nodos, y para el tambor, ambos pueden ser lineales, cuando l = 2. En 3D, esto da lugar a los “orbitales d”, con funciones de onda “margarita” de 4 lóbulos, cada una con 2 nodos planos perpendiculares. En el caso de los d orbitales los subíndices son más difíciles de seguir. Puedes desacercarlos a partir de los Jmols, los diagramas de densidad de puntos y los diagramas de superficie orbital si lo deseas, pero el análisis de estos orbitales suele considerarse más allá del alcance de la química general. Debe, sin embargo, ser consciente de que existen cinco posibles orientaciones para d orbitales. A continuación se presentan representaciones de los d orbitales. Como todos tienen 2 nodos, todos tienen la misma energía en el átomo de hidrógeno, pero diferentes energías cuando se agregan más electrones.
| Designación orbital | Vibración de tambor | Rotación Orbital | Diagrama de superficie de contorno |
| 3 d xy |
modo m 3,2 planos nodales xz e yz |
 |
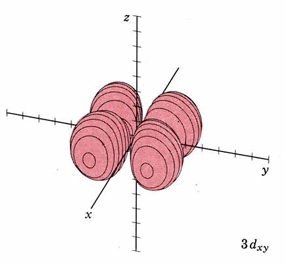
|
| 3 d xz | igual que arriba, planos nodales xy y zy |  |
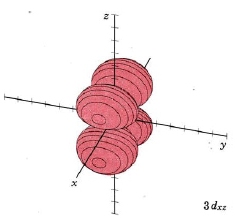
|
| 3 d yz | igual que arriba, planos nodales xy y xz |  |
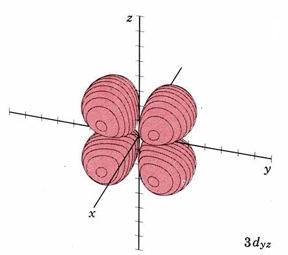
|
| 3 d x 2 -y 2 | igual que arriba, planos nodales a través de z bisectando x, y |  |
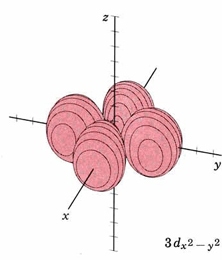
|
| 3 d z 2 | sin modo correspondiente; planos nodales en forma de embudo |
 |
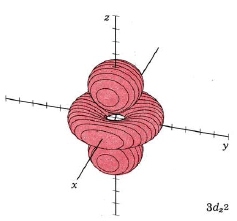
|
El mismo patrón se extiende hasta n = 4 donde se encuentran cuatro tipos orbitales, a saber, 4 s, 4 p, 4 d y 4 f. Si bien ninguno de estos orbitales se mostrará, los patrones observados al pasar de 1 s a 2 s o de 2 p a 3 p continúan con los orbitales s, p y d. Los nuevos orbitales f son aún más complicados que los orbitales d. Para una comprensión de la química general, es importante saber que existen siete orientaciones diferentes para los orbitales f, ya que el número de orbitales de cada tipo (s, p, d, etc.) es importante para determinar la estructura de concha del átomo.
Orbitales en la Web
Orbitron: [1] Visor orbital de D. Manthey: [2] Falstad.com: [3] JCE: [4] Darmstadt: [5] [6]
Referencias
- ↑ 1 Todos los diagramas de densidad de puntos y diagramas de superficie límite son Copyright © 1975 por W. G. Davis y J. W. Moore.










