6.5: Configuraciones de iones y electrones de gas noble
- Page ID
- 75813
Al considerar la formación de LiH, un aspecto merece explicación. Si la transferencia de un electrón de Li a H es energéticamente favorable, ¿por qué no es cierto lo mismo para la transferencia de un segundo electrón para producir Li 2+ H 2—? Ciertamente, las cargas dobles en Li 2+ y H 2 —atraerían más fuertemente que las cargas simples en Li + y H —, y los iones doblemente cargados se mantendrían más apretados en la red cristalina. La respuesta a esta pregunta se puede encontrar mirando hacia atrás en el diagrama a continuación.
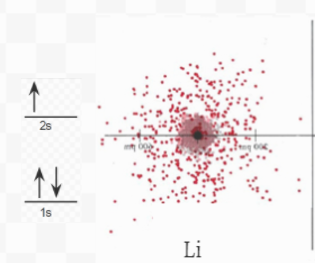
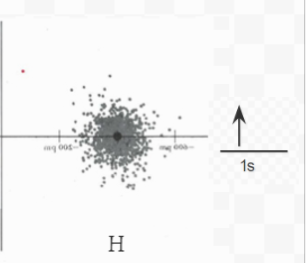
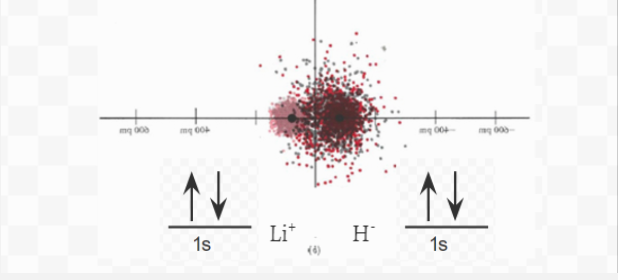
Figura 6.5.1 La imagen anterior muestra diagramas de densidad electrónica para Litio, Hidrógeno y el compuesto iónico LiH. Junto a cada elemento se encuentra el diagrama orbital electrónico, que muestra s la forma simbólica del diagrama de densidad electrónica.
La eliminación de un segundo electrón de Li requeriría mucha más energía que la eliminación del primero porque este segundo electrón sería un electrón de 1 s (del círculo más pequeño de la imagen de arriba, más cerca del núcleo) en lugar de un electrón de 2 s. No sólo este segundo electrón está mucho más cerca del núcleo, sino que también está muy mal blindado del núcleo, lo que significa que su atracción hacia el núcleo es fuerte. No es sorprendente, por lo tanto, que la segunda energía de ionización de Li (la energía requerida para eliminar este segundo electrón) sea 7297 kJ mol —1 ¡casi 14 veces más grande que la primera energía de ionización! Tal colosal requerimiento de energía es suficiente para asegurar que solo se eliminará el electrón más externo (el electrón de valencia) de Li y que el núcleo interno de 1 s con su configuración electrónica de tipo helio permanecerá intacto.
Un argumento similar se aplica a la aceptación de un segundo electrón por el átomo H para formar el ion H 2—. Si se formara tal ion, el electrón extra tendría que ocupar el orbital de 2 s (fuera de la mezcla de puntos rojos y grises del ion H que se muestra arriba). Su nube de electrones se extendería lejos del núcleo (incluso más lejos que para el electrón de 2 s en Li, porque la carga nuclear en H 2— solo sería +1, a diferencia de +3 en Li), y sería bastante alta en energía. Se necesitaría tanta energía para obligar a un segundo electrón a moverse alrededor del núcleo H de esta manera, que sólo se transfiere un electrón. El ion formado tiene la fórmula H — y una estructura electrónica de tipo helio 1 s 2 en lugar de un ion H 2- con una estructura electrónica 1s 2 2s 1.
El ejemplo simple de hidruro de litio es típico de todos los compuestos iónicos que se pueden formar por combinación de dos elementos. Invariablemente encontramos que uno de los dos elementos tiene una energía de ionización relativamente baja y es capaz de perder fácilmente uno o más electrones. El otro elemento tiene una afinidad electrónica relativamente alta y es capaz de aceptar uno o más electrones en su estructura. Los iones formados por esta transferencia de electrones casi siempre tienen una estructura electrónica que es la misma que la del gas noble, y todos los electrones están emparejados en cada ion. El compuesto resultante es siempre un sólido en el que los iones están dispuestos en una matriz tridimensional o red cristalina similar, aunque no siempre idéntica a la que se muestra en la red cristalina de LiH a continuación.
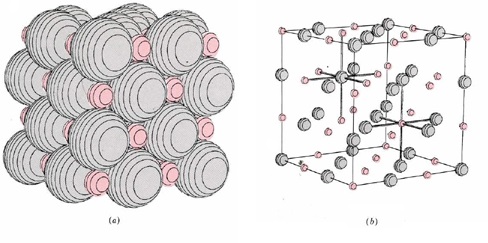
En tal sólido los vecinos más cercanos de cada anión son siempre cationes y viceversa, y el sólido se mantiene unido por las fuerzas de atracción entre los iones de signo opuesto. Un ejemplo cotidiano de tal compuesto iónico es la sal de mesa ordinaria, el cloruro de sodio, cuya fórmula es NaCl. Como veremos en la siguiente sección, el sodio es un elemento con una baja energía de ionización, y el cloro es un elemento con una alta afinidad electrónica.
A nivel microscópico, los cristales de cloruro de sodio consisten en una matriz de iones de sodio, Na +, e iones cloruro, Cl —, empaquetados juntos en una red como la que se muestra para el hidruro de litio. Los iones cloruro son átomos de cloro los cuales han ganado un electrón y así tienen la estructura electrónica 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6, la misma que la del argón de gas noble. Los iones de sodio son átomos de sodio que han perdido un electrón, dándoles la estructura 1 s 2 2 s 2 2 p 6, la misma que la del neón de gas noble. Todos los electrones en ambos tipos de iones están emparejados.


