6.6: Energías de ionización
- Page ID
- 75668
En la figura se\(\PageIndex{1}\) grafican las energías de ionización de los elementos contra el número atómico. Una característica obvia de esta figura es que los elementos con las mayores energías de ionización son los gases nobles. Dado que la energía de ionización mide la energía que debe suministrarse para eliminar un electrón, estos altos valores hacen que sea difícil eliminar un electrón de un átomo de un gas noble.
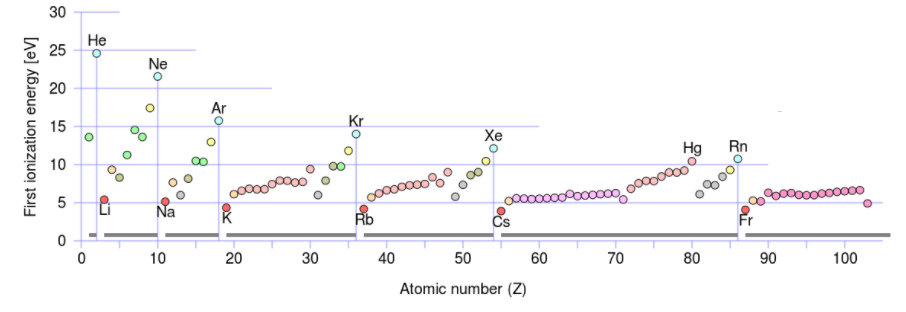
Una segunda característica obvia es que los elementos con las energías de ionización más bajas son los metales alcalinos. Esto significa que es más fácil eliminar electrones de los átomos de este grupo de elementos que de cualquier otro grupo. Una inspección más cercana también revela las siguientes dos tendencias generales:
- A medida que se mueve hacia abajo un grupo dado en la tabla periódica, la energía de ionización disminuye. En el grupo I, por ejemplo, las energías de ionización disminuyen en el orden Li > Na > K > Rb > Cs. La razón de esto es un aumento constante en el tamaño de la nube de electrones de valencia a medida que aumenta el número cuántico principal n. El electrón de valencia de 6 s de Cs, por ejemplo, está más lejos del núcleo y por lo tanto es más fácil de eliminar que el electrón de valencia de 5 s de Rb.
- A medida que uno se mueve de izquierda a derecha a través de la tabla periódica (de un átomo de metal alcalino a un gas noble), la energía de ionización aumenta en su conjunto. En tal movimiento el valor n de los electrones más externos sigue siendo el mismo, pero la carga nuclear aumenta de manera constante. Esta mayor atracción nuclear requiere que más trabajo haya realizado para eliminar un electrón, y así la energía de ionización sube.
Se pueden confirmar estas tendencias generales inspeccionando Figura\(\PageIndex{1}\). A medida que uno se mueve de He a Ne a Ar se pueden ver marcadas disminuciones en la energía de ionización, confirmando la tendencia a disminuir la energía de ionización a medida que se mueve hacia abajo de un grupo. Al pasar de izquierda a derecha a través de la tabla periódica se produce un incremento en la energía de ionización, como puede observarse por la tendencia alcista a medida que se va de Li a Ne.
Las energías de ionización se pueden medir con bastante precisión para los átomos, y los valores obtenidos muestran algunas características adicionales que son menos importantes que las dos tendencias principales mencionadas anteriormente. Por ejemplo, considere los datos para los elementos de la segunda fila de la tabla periódica. Los valores numéricos para las energías de ionización relevantes se muestran en la Figura\(\PageIndex{2}\) de energías de ionización y afinidades de electrones a continuación.
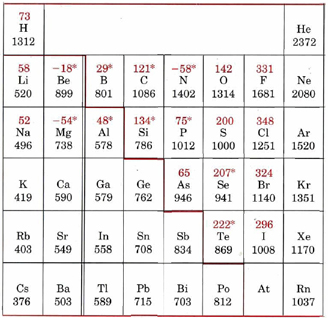
La tendencia general de aumentar la energía de ionización a través de la tabla se rompe en dos puntos. El boro tiene un valor menor que el berilio, y el oxígeno tiene un valor menor que el nitrógeno. La primera ruptura ocurre cuando el primer electrón se agrega a una subcapa p. Como se mencionó varias veces en el capítulo anterior, un electrón de 2 p es mayor en energía y por lo tanto más fácil de eliminar que un electrón de 2 s porque está blindado de manera más eficiente de la carga nuclear. Así, el electrón 2 p en boro es más fácil de eliminar que un electrón de 2 s en berilio.
La segunda excepción a la tendencia general se da en el caso del oxígeno, que tiene un electrón más de 2 p que la subcapa de nitrógeno medio llena. El último electrón en el átomo de oxígeno es forzado a entrar en un orbital ya ocupado donde se mantiene cerca de otro electrón. La repulsión entre estos dos electrones hace que uno de ellos sea más fácil de eliminar, por lo que la energía de ionización del oxígeno es menor de lo que podría esperarse.
Estas discontinuidades también aparecen periódicamente, como sería de esperar ya que surgen de la estructura de los electrones de valencia. El azufre y el selenio, en el mismo grupo que el oxígeno, muestran la discontinuidad en la tendencia al aumento de la energía de ionización, la cual surge del mismo efecto de subcapa semillenada. El aluminio y el galio, ambos en el mismo grupo que el boro, muestran de manera similar una disminución en la energía de ionización en comparación con el magnesio y el calcio.
Si bien esta tendencia no parece aplicarse para el indio, y el talio, es importante recordar que al gráfico le faltan los metales de transición. Al observar la gráfica de las energías de ionización, es claro que el indio (número atómico 49) sí tiene una energía de ionización menor que el cadmio (número atómico 48), y lo mismo ocurre con el mercurio, el elemento que precede al talio (número atómico 81).
A continuación se muestra una tabla periódica completa, con sombreado para demostrar la tendencia periódica de la energía de ionización. Cuanto más oscuro es el sombreado, mayor es la energía de ionización. Observe la tendencia general de aumentar la oscuridad (o energía de ionización) a medida que uno se mueve hacia la derecha y hacia arriba. Tómate un momento para anotar por qué esto es así.



