6.11: Propiedades Físicas
- Page ID
- 75709
Los compuestos iónicos binarios tienen muchas propiedades macroscópicas en común, algunas de las cuales son fáciles de explicar en términos de la imagen microscópica que se acaba de presentar. Debido a que cada ion en una red cristalina, como los que se muestran para el hidruro de litio y el fluoruro de calcio, está rodeado por muchos vecinos más cercanos con carga opuesta, cada ion se mantiene bastante firmemente en su posición asignada. A temperatura ambiente cada ion puede vibrar ligeramente alrededor de su posición media, pero se debe agregar mucha más energía antes de que un ion pueda moverse lo suficientemente rápido y lo suficientemente lejos como para comenzar a escapar de la atracción de sus vecinos. Por lo tanto, se necesita una temperatura bastante alta para fundir un compuesto iónico. Los puntos de fusión de algunas sustancias que hemos considerado son: LiH, 680°C; NaCl, 801°C; CaF 2, 1360°C Una vez que se funde un sólido iónico, los iones individuales pueden moverse, aunque la mayoría de los vecinos más cercanos de cada anión seguirán siendo cationes y viceversa. Un rasgo característico de dicho compuesto iónico fundido es que conduce electricidad. Si se colocan dos cables en la masa fundida y se conectan a una batería, los iones positivos en la masa fundida se moverán gradualmente hacia el cable cargado negativamente, mientras que los iones negativos se moverán hacia el cable cargado positivamente. El movimiento de iones cargados a través de la masa fundida constituye el paso de una corriente eléctrica tal como lo hace el movimiento de electrones a través de un cable metálico. Su ocurrencia puede ser detectada por un medidor eléctrico apropiado.
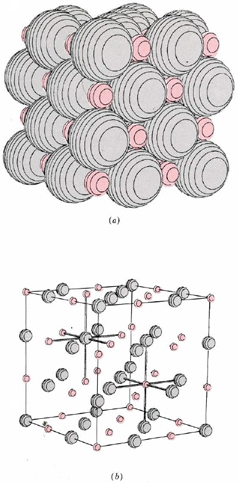
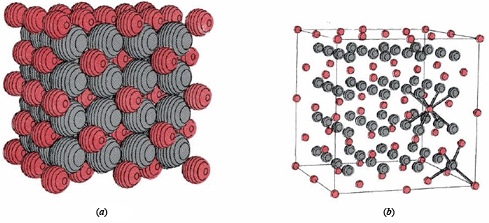
Tanto el punto de fusión del sólido como la conductividad eléctrica del líquido proporcionan pistas valiosas para decidir si un compuesto es iónico o no. Un ejemplo interesante de esto es una comparación entre fluoruro de aluminio, AlF 3, y bromuro de aluminio, AlBr 3. Encontramos que el AlF 3 tiene un punto de fusión de 1040°C, y la masa fundida conduce la electricidad. Por el contrario, el AlBr 3 se funde a 97.5°C, y el fundido no conduce electricidad. La inferencia obvia es que el primer compuesto es iónico, mientras que el segundo no lo es.
Los cristales de sustancias iónicas son transparentes, duros, quebradizos y tienen formas características. También se escinden fácilmente. Esto significa que si un instrumento en forma de cuña (como una hoja de cuchillo) se coloca correctamente sobre un cristal y se toca bruscamente, el cristal se romperá limpiamente en dos. Esto se puede ver en el siguiente video:
Cuando el cuchillo se coloca paralelo a los planos del cristal, rompe el primer cristal en dos nuevos cristales, con caras que son planos casi perfectos. Además, cuando la cuchilla no se coloca alineada con el plano, sino en un ángulo de 45°, el cristal se rompe en lugar de romperse uniformemente. Aún así, la ruptura más limpia ocurre a lo largo del plano del cristal. La dureza de los cristales iónicos es consecuencia de las fuertes fuerzas culómbicas que mantienen cada ion en su posición asignada. La forma y escisión de un cristal son el resultado de la disposición geométrica específica de los iones en una red cristalina. Por ejemplo, dado que los ángulos de 90° ocurren entre capas de iones en la red microscópica de NaCl (y LiH), los ángulos de 90° también son razonables en los cristales macroscópicos de NaCl. (Si examinas algunos cristales pequeños de un salero, verás que esto es cierto, ¡algunos son cubos casi perfectos!) Por lo tanto, a menudo se pueden usar formas y escisiones características para distinguir un compuesto iónico de otro.
La siguiente animación muestra lo que ocurre en la escala atómica cuando se escinde el cristal de NaCl.
Cuando se aplica una gran fuerza paralela a una capa de iones en la red cristalina, puede desplazar esa capa con respecto a la siguiente. Solo se necesita un pequeño cambio antes de que los iones positivos en una capa sean adyacentes a los iones positivos en la otra, y los iones negativos se conviertan en vecinos más cercanos. Las dos porciones de la celosía se repelen entre sí y se desmoronan. A nivel macroscópico el cristal se escinde, dejando caras planas correspondientes a cada capa de iones.
Quizás la propiedad más importante de los sólidos iónicos es que la mayoría de ellos se disuelven en agua. Testimonio mudo de esto es proporcionado por las filas y filas de botellas en el laboratorio de química promedio que contienen soluciones iónicas acuosas. Un rasgo característico de estas soluciones es que todas conducen electricidad, lo que demuestra que los iones retienen sus cargas en solución y también son libres de moverse en ella. Cuando el cloruro de bario, BaCl 2, se disuelve en agua, por ejemplo, los iones Ba 2 + y Cl, que se mantuvieron firmemente unidos en la red cristalina se separan entre sí en solución y pueden moverse independientemente. Si ahora dos cables están sumergidos en esta solución y unidos a una batería, ocurre casi lo mismo que en el caso de una sal fundida. Los iones Ba 2 + son atraídos por la carga negativa en un cable y se mueven hacia él, mientras que los iones Cl — se mueven hacia la carga positiva en el otro cable. Este flujo de cargas en el cuerpo de la solución se corresponde con un flujo de electrones en el cable y se puede medir con un medidor apropiado.


