6.10: La regla del octeto
- Page ID
- 75669
Debido a que los compuestos iónicos binarios están confinados principalmente a los elementos del grupo 1 y del grupo 2 por un lado y a los elementos del grupo VI y VII por el otro, encontramos que consisten principalmente en iones que tienen una estructura electrónica que es la misma que la de un gas noble. En el fluoruro de calcio, por ejemplo, el átomo de calcio ha perdido dos electrones para lograr la estructura electrónica del argón, y así tiene una carga de +2:
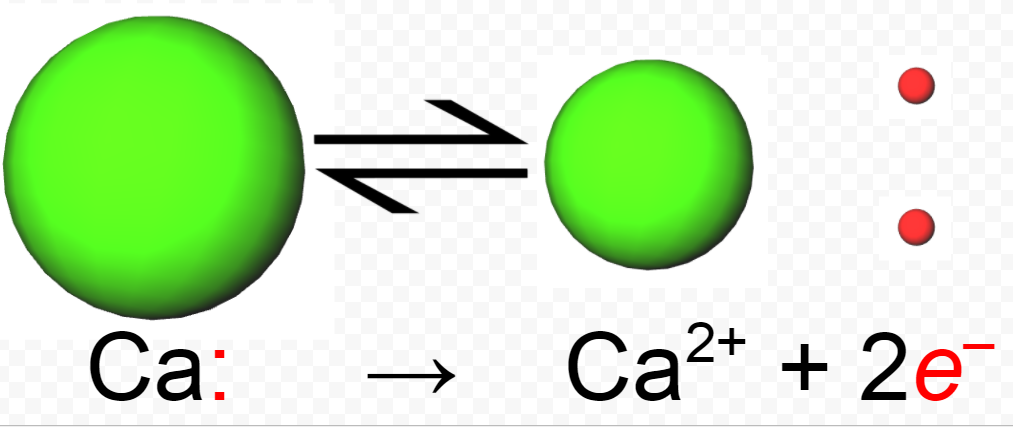
1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 → 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 + 2 e —
Por el contrario, un átomo de flúor necesita adquirir solo un electrón para lograr una estructura de neón. El ion fluoruro resultante tiene una carga de —1:
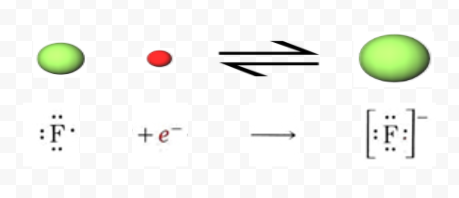
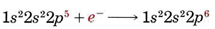
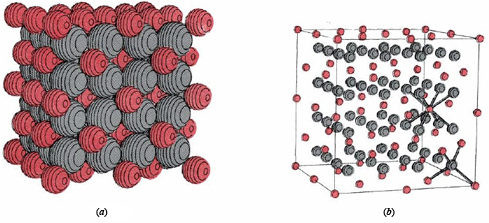
La capa más externa de cada uno de estos iones tiene la configuración electrónica ns 2 np 6, donde n es 3 para Ca 2 + y 2 para F —. Tal configuración de electrones de gas noble ns 2 np 6 se encuentra con bastante frecuencia. Se le llama octeto porque contiene ocho electrones. En un cristal de fluoruro de calcio, los iones Ca 2 + y F — se empaquetan juntos en la red que se muestra a continuación. El estudio cuidadoso del diagrama muestra que cada ion F — está rodeado por cuatro iones Ca 2 +, mientras que cada ion Ca 2 + tiene ocho iones F — como vecinos más cercanos.
Por lo tanto, debe haber el doble de iones F — que iones Ca 2 + en toda la red cristalina. Solo se muestra una pequeña porción de la celosía, pero si se extendiera indefinidamente en todas las direcciones, se podría verificar la relación de dos F — por cada Ca 2 +. Esta relación tiene sentido si se considera que se necesitan dos iones F — (cada uno con una carga —1) para equilibrar la carga +2 de cada ion Ca 2 +, haciendo que la carga neta en el cristal sea cero. La fórmula para el fluoruro de calcio es, por lo tanto, CaF 2.
Los recién llegados a la química suelen tener dificultades para decidir cuál será la fórmula de un compuesto iónico. Un método conveniente para hacer esto es considerar el compuesto como formado a partir de sus átomos y usar diagramas de Lewis. Entonces se puede aplicar la regla del octeto. Cada átomo debe perder o ganar electrones para lograr un octeto. Además, todos los electrones perdidos por un tipo de átomo deben ser ganados por el otro.
Una excepción a la regla del octeto ocurre en el caso de los tres iones que tienen la estructura He 1 s 2, es decir, H —, Li + y Be 2 +. En estos casos se necesitan dos en lugar de ocho electrones en la capa más externa para cumplir con la regla.
Encuentra la fórmula del compuesto iónico formado a partir de O y Al.
Solución
Primero escribimos diagramas de Lewis para cada átomo involucrado:
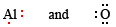
Ahora vemos que cada átomo O necesita 2 electrones para formar un octeto, mientras que cada átomo de Al tiene 3 electrones para donar. Para que se donara el mismo número de electrones como se acepta, necesitamos 2 átomos de Al (2 × 3 e — donados) y 3 átomos de O (3 × 2 e — aceptados). Todo el proceso es entonces
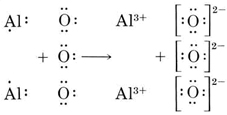
El óxido resultante consiste en iones aluminio, Al 3 +, e iones óxido, O 2—, en la proporción de 2:3. La fórmula es Al 2 O 3.


