6.14: Las moléculas covalentes y la regla del octeto
- Page ID
- 75776
La idea de que una molécula podría ser mantenida unida por un par compartido de electrones fue sugerida por primera vez por Lewis en 1916. Aunque Lewis nunca ganó el premio Nobel por esta o sus muchas otras teorías, el par compartido de electrones es sin embargo una de las contribuciones más significativas a la química de todos los tiempos. La mecánica de las olas seguía siendo de 10 años en el futuro, por lo que Lewis no pudo dar ninguna descripción matemática de exactamente cómo era posible compartir electrones. En lugar de la imagen detallada presentada en la sección anterior, Lewis indicó la formación de una molécula de hidrógeno a partir de dos átomos de hidrógeno con la ayuda de sus diagramas de electrones y puntos de la siguiente manera:
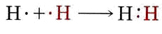
Lewis también sugirió que la tendencia a adquirir una estructura de gas noble-gas no se limita a compuestos iónicos sino que también ocurre entre los compuestos covalentes. En la molécula de hidrógeno, por ejemplo, cada átomo de hidrógeno adquiere cierto control sobre dos electrones, logrando así algo parecido a la estructura del helio. De manera similar, la formación de una molécula de flúor a partir de sus átomos puede ser representada por
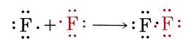
Nuevamente se comparte un par de electrones, permitiendo que cada átomo alcance una estructura de neón con ocho electrones (es decir, un octeto) en su caparazón de valencia. Se pueden usar diagramas similares para describir las otras moléculas halógenas:
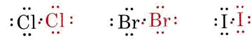
En cada caso, un par compartido de electrones contribuye a una configuración de electrones de gas noble-en ambos átomos. Dado que solo los electrones de valencia se muestran en estos diagramas, el logro de una estructura de gas noble-es fácilmente reconocido como el logro de un complemento completo de ocho puntos de electrones (un octeto) alrededor de cada símbolo. En otras palabras, tanto los compuestos covalentes como los iónicos obedecen a la regla del octeto.
La regla del octeto es muy útil, aunque de ninguna manera infalible, para predecir las fórmulas de muchos compuestos covalentes, y permite explicar la valencia habitual que exhiben muchos de los elementos representativos. Según la teoría de Lewis, el hidrógeno y los halógenos presentan cada uno una valencia de 1 porque los átomos de hidrógeno y los halógenos contienen cada uno un electrón menos que un átomo de gas noble-gas. Para lograr una estructura de gas noble-gas, por lo tanto, solo necesitan participar en el reparto de un par de electrones. Si identificamos un par compartido de electrones con un enlace químico, estos elementos solo pueden formar un enlace.
Un argumento similar puede extenderse al oxígeno y a los elementos del grupo VI para explicar su valencia de 2. Aquí se necesitan dos electrones para completar una configuración de gas noble-gas. Al compartir dos pares de electrones, es decir, al formar dos enlaces, se obtiene un octeto:
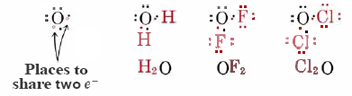
El nitrógeno y los elementos del grupo V también requieren tres electrones para completar sus octetos, y así pueden participar en tres pares compartidos:
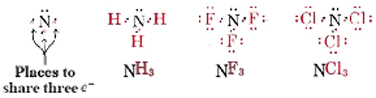
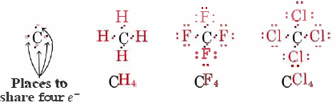
Finalmente, dado que el carbono y los elementos del grupo IV tienen cuatro vacantes en sus conchas de valencia, son capaces de formar cuatro enlaces:
Dibujar estructuras de Lewis y predecir las fórmulas de compuestos que contienen (a) P y Cl; (b) Se y H.
Solución:
a) Dibujar diagramas de Lewis para cada átomo.
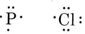
Dado que el átomo de P puede compartir tres electrones y el átomo de Cl solo uno, se requerirán tres átomos de Cl, y la fórmula es
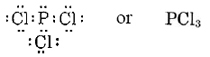
b) Dado que Se está en el grupo periódico VI, carece de dos electrones de configuración de gas noble-gas y por lo tanto tiene una valencia de 2. La fórmula es
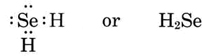
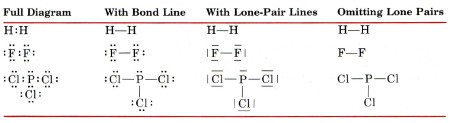
Al dibujar las estructuras de Lewis, los pares de unión de electrones a menudo se indican mediante una línea de enlace que conecta los átomos que mantienen juntos. Los electrones que no están involucrados en la unión generalmente se denominan pares solitarios o pares no compartidos. Los pares solitarios a menudo se omiten en los diagramas de Lewis, o también pueden indicarse por líneas. Estas son algunas de las formas alternativas en las que se pueden escribir H 2, F 2 y PCl 3.