6.15.1: Un exceso de bonos
- Page ID
- 75720
Volver a Escribir Estructuras de Lewis para Moléculas
Hay una serie de casos en los que las valencias normales de los átomos involucrados no predicen la estructura correcta del esqueleto. Por ejemplo, se encuentra experimentalmente que el cloruro de tionilo, SOCl 2, tiene tanto cloros como el átomo de oxígeno unidos al azufre:
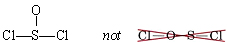
Esto supera la valencia habitual de 2 para el azufre, mientras que el oxígeno tiene un enlace menos de lo que podríamos haber esperado. Las moléculas que se desvían de esta manera de las reglas de valencia habituales suelen contener al menos un átomo (como S) de la tercera fila o abajo en la tabla periódica. Uno o más átomos de oxígeno generalmente están unidos solo a ese átomo de la tercera fila en lugar de unir un par de otros átomos. Por lo general, el átomo que ocupa la posición central en el esqueleto se escribe primero en la fórmula molecular, aunque a veces H (que forma un solo enlace y no puede ser el átomo central) lo precede. Algunos ejemplos (con el átomo central en cursiva) son: S OCl 2, P OCl 3, H Cl O 4, S O 2 Br 2 y N 2 O. (En el último caso, uno de los dos nitrógenos ocupa el centro posición.)
En tales moléculas la desviación de la valencia normal ocurre porque al menos un enlace de par de electrones contiene dos electrones que originalmente se asociaron con el mismo átomo. Tal enlace se denomina enlace covalente coordinado o enlace dativo. Un ejemplo es el enlace entre azufre y oxígeno en SOCl 2:
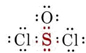
Ambos electrones en el enlace S—O eran originalmente electrones de valencia de azufre. Por lo tanto, la compartición de este par de electrones no agrega nada a la capa de valencia del azufre, y el azufre puede formar un enlace más de lo que sería predicho por su valencia normal. Ninguno de los electrones en el enlace covalente coordinado se asoció originalmente con el oxígeno, y un enlace simple (ambos electrones) es suficiente para proporcionar un octeto cuando se agrega a los seis electrones de valencia del oxígeno. De ahí que el oxígeno forme un enlace menos de lo esperado.
Cabe señalar que no hay nada que distinga un enlace covalente coordinado de cualquier otro enlace covalente una vez que se ha dibujado una fórmula estructural. Un par de electrones sigue siendo un par de electrones sin importar de dónde provenga. La distinción es simplemente una que hacemos cuando tratamos de encajar pares de electrones en octetos alrededor de cada átomo. Las fórmulas estructurales para los otros ejemplos de valencia inusual que hemos mencionado se muestran a continuación con enlaces covalentes coordinados indicados en color:
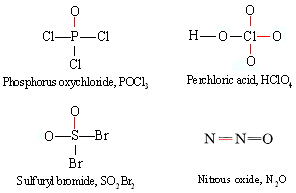
Es una buena práctica dibujar el diagrama completo de Lewis para cada una de estas moléculas, diferenciando electrones de diferentes núcleos con diferentes símbolos como × y ●, y satisfacerse que obedecen a la regla del octeto.


