6.15.2: Decidir sobre una estructura de esqueleto
- Page ID
- 75707
Volver a Escribir Estructuras de Lewis para Moléculas
La estructura del esqueleto de una molécula covalente a menudo se puede determinar considerando las valencias de los átomos constituyentes. Por lo general, el átomo que forma el mayor número de enlaces se encuentra en el centro del esqueleto, donde puede conectarse al número máximo de otros átomos.
fórmula estructural.
Solución Hay varias formas posibles de unir los átomos
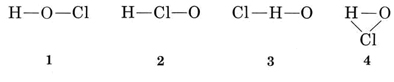
La valencia habitual de H es 1, por lo que las estructuras 3 y 4, que tienen dos enlaces a H, pueden eliminarse. La valencia habitual de Cl también es 1, por lo que también se puede descartar la estructura 2. La estructura 1 muestra H formando un enlace, Cl formando uno y O formando dos, de acuerdo con las valencias habituales, y así se elige.
El número total de electrones de valencia disponibles es 1 de H más 6 de O más 7 de Cl, o 14. Llenando estos en el esqueleto que tenemos
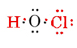
Tenga en cuenta que O, que tenía la valencia más grande, está en el centro del esqueleto.
Dibuje una fórmula estructural para hidroxilamina, NH 3 O.
Solución En este caso N tiene la mayor valencia (3), seguida de O (2) y H (1). Tanto el N como el O pueden formar “puentes” entre otros átomos, pero H no puede. Por lo tanto colocamos N y O en el centro del esqueleto para dar
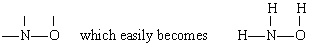
por adición de los tres átomos de H.
Hay un total de 5 + 3 + 6 = 14 electrones de valencia de N, 3H's y O. Estos se pueden colocar de la siguiente manera:
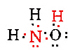
Una vez que se ha determinado el diagrama de Lewis, la fórmula molecular a menudo se reescribe para recordarnos cuál es la fórmula estructural. Por ejemplo, la fórmula molecular para la hidroxilamina suele escribirse NH 2 OH en lugar de NH 3 O para recordarnos que dos H están unidos a N y uno a O. Se supone que la persona que lee la fórmula se dará cuenta de que N y O tienen cada uno un electrón de valencia para compartir entre sí , conectando —NH 2 con —OH. En algunos casos más de una estructura esquelética satisfará la valencia de cada átomo y también la regla del octeto. Por ejemplo, puede verificar que la fórmula molecular C 2 H 6 O corresponde a ambos de los siguientes:
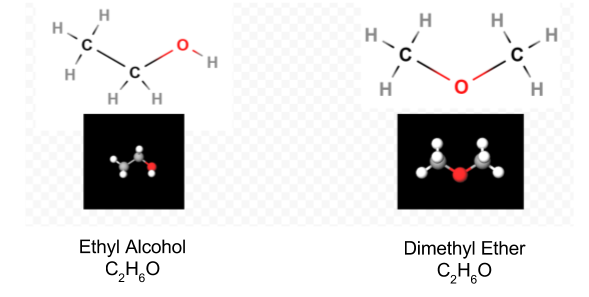
En tal caso sólo podemos decidir qué estructura molecular tenemos por experimento. Las propiedades del alcohol etílico cuando se diluye con agua y se consume son bien conocidas. El éter dimetílico es un gas. Al igual que el éter dietílico que se usa en los quirófanos, es altamente explosivo y puede hacerte dormir. Dos moléculas, como el éter dimetílico y el alcohol etílico, que tienen la misma fórmula molecular pero diferentes fórmulas estructurales se dice que son isómeros.
Volver a Escribir Estructuras de Lewis para Moléculas
Agradecimientos:
Las moléculas C 2 H 6 O y sus estructuras esqueléticas se crearon usando MolView.


