6.15.3: Bonos Múltiples
- Page ID
- 75706
Volver a Escribir Estructuras de Lewis para Moléculas
Para cumplir con los requisitos de valencia normal, a veces es necesario tener más de un enlace, es decir, más de un par compartido de electrones entre dos átomos. Un ejemplo de ello es el formaldehído, CH 2 O. Para proporcionar carbono con cuatro enlaces en esta molécula, debemos considerar que el carbono forma dos enlaces al oxígeno así como uno a cada uno de los dos hidrógenos. Al mismo tiempo, el átomo de oxígeno también está provisto de los dos enlaces que requiere su valencia normal:
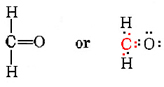
Tenga en cuenta que los cuatro electrones compartidos en el enlace carbono-oxígeno están incluidos tanto en el octeto de carbono como en el octeto de oxígeno. Un enlace que involucra dos pares de electrones se llama doble enlace.
Ocasionalmente las valencias habituales de los átomos en una molécula no nos dicen cuál debería ser la estructura del esqueleto. Por ejemplo, en monóxido de carbono, CO, es difícil ver cómo se puede emparejar un átomo de carbono (valencia habitual de 4) con un solo átomo de oxígeno (valencia habitual de 2). En un caso como este, donde las valencias parecen ser incompatibles, contar electrones de valencia suele conducir a una estructura que satisface la regla del octeto. El carbono tiene 4 electrones de valencia y el oxígeno tiene 6, para un total de 10. Queremos organizar estos 10 electrones en dos octetos, pero dos grupos separados de 8 electrones requerirían 16 electrones. Sólo compartiendo 16 — 10, o 6, electrones (para que esos 6 electrones sean parte de cada octeto y, en efecto, cuenten dos veces) podremos satisfacer la regla del octeto. Esto lleva a la estructura
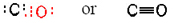
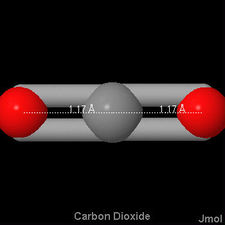
Aquí se comparten tres pares de electrones entre dos átomos, y tenemos un triple enlace. Los enlaces dobles y triples no son simplemente dispositivos para ayudar a encajar los diagramas de Lewis en la teoría del octeto. Tienen una existencia objetiva, y su presencia en una molécula a menudo tiene un profundo efecto sobre cómo reacciona con otras moléculas. Los enlaces triples son invariablemente más cortos que los dobles enlaces, que a su vez son más cortos que los enlaces simples. En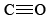 , por ejemplo, la distancia carbono-oxígeno es de 114pm, en
, por ejemplo, la distancia carbono-oxígeno es de 114pm, en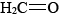 ella es de 121pm, mientras que tanto en alcohol etílico como dimetil éter y metanol es de 142pm. A continuación se muestran imágenes 3-D Jmol de monóxido de carbono, formaldehído y metanol, para comparar la diferencia en la longitud del enlace con.
ella es de 121pm, mientras que tanto en alcohol etílico como dimetil éter y metanol es de 142pm. A continuación se muestran imágenes 3-D Jmol de monóxido de carbono, formaldehído y metanol, para comparar la diferencia en la longitud del enlace con.
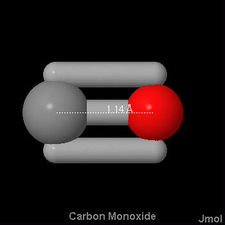
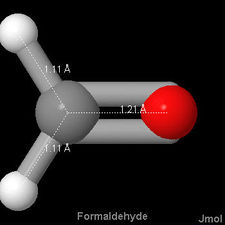
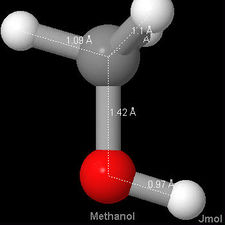
Esto concuerda con la imagen onda-mecánica del enlace químico como causada por la concentración de densidad electrónica entre los núcleos. Cuantos más pares de electrones se compartan, mayor será esta densidad y más estrechamente se juntan los átomos. En línea con esto, también esperaríamos que los bonos múltiples fueran más fuertes que los bonos simples. De hecho, la energía de enlace de C—O se encuentra experimentalmente que es 360 kJ mol —1, mientras que la de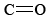 es 736 kJ mol —1, y la de
es 736 kJ mol —1, y la de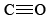 es una gigantesca 1072 kJ mol —1. El
es una gigantesca 1072 kJ mol —1. El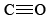 triple enlace en el monóxido de carbono resulta ser el enlace covalente más fuerte conocido.
triple enlace en el monóxido de carbono resulta ser el enlace covalente más fuerte conocido.
La formación de dobles y triples enlaces no está tan extendida entre los átomos de la tabla periódica como cabría esperar. Al menos uno de los átomos involucrados en un enlace múltiple es casi siempre C, N u O, y en la mayoría de los casos ambos átomos son miembros de este trío. Otros elementos completan sus octetos formando enlaces simples adicionales en lugar de enlaces múltiples.
Solución Dado que los átomos de hidrógeno son univalentes, ciertamente todos deben estar unidos a átomos de carbono, presumiblemente dos por cada carbono. Cada átomo de carbono tiene así la situación
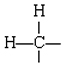
en el que aún deben contabilizarse dos bonos. Al asumir que los dos átomos de carbono están unidos por un doble enlace, se cumplen todos los requisitos de valencia, y podemos dibujar una estructura de Lewis que contenga octetos satisfactorios:
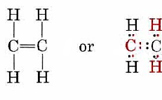
2 y SiO 2.
Solución:
a) El carbono requiere cuatro enlaces, y cada oxígeno requiere dos enlaces, por lo que dos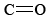 dobles enlaces satisfarán las valencias normales. La estructura es
dobles enlaces satisfarán las valencias normales. La estructura es
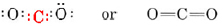
Al observar la imagen de Jmol para esta molécula, los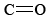 dobles enlaces tienen una distancia más corta que los que se ven en el formaldehído, pero son más largos que el triple enlace en el monóxido de carbono:
dobles enlaces tienen una distancia más corta que los que se ven en el formaldehído, pero son más largos que el triple enlace en el monóxido de carbono:
b) El silicio también tiene una valencia normal de 4, pero no es un elemento que forme fácilmente dobles enlaces. Sin embargo, cada silicio puede formar enlaces sencillos a cuatro átomos de oxígeno,
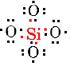
Ahora el silicio está satisfecho, pero cada oxígeno carece de un electrón y sólo ha formado un enlace. Si cada uno de los oxígenos se une a otro silicio, quedarán satisfechos, pero luego los átomos de silicio agregados tendrán valencias no utilizadas:
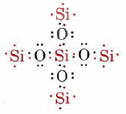
El proceso de adición de átomos de oxígeno o silicio puede continuar indefinidamente, produciendo una red gigante de átomos unidos covalentemente. En esta molécula gigante cada silicio está unido a cuatro oxígenos y cada oxígeno a dos siliconas, por lo que hay tantos átomos de oxígeno como el silicio. La fórmula molecular podría escribirse (SiO 2) n donde n es un número muy grande. A continuación se muestra una porción de esta molécula gigante.
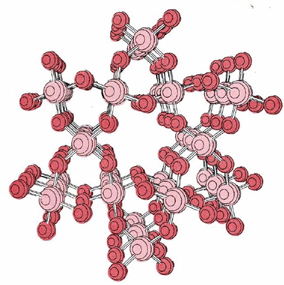 Una porción de la molécula covalente gigante (SiO2) n. La celosía mostrada se extendería indefinidamente en todas las direcciones en un cristal macroscópico. Cada átomo de silicio (color claro) está unido covalentemente a cuatro átomos de oxígeno (color oscuro). Cada oxígeno se une a dos siliconas. La relación de silicio a oxígeno es 2:4 o 1:2, de acuerdo con la fórmula.
Una porción de la molécula covalente gigante (SiO2) n. La celosía mostrada se extendería indefinidamente en todas las direcciones en un cristal macroscópico. Cada átomo de silicio (color claro) está unido covalentemente a cuatro átomos de oxígeno (color oscuro). Cada oxígeno se une a dos siliconas. La relación de silicio a oxígeno es 2:4 o 1:2, de acuerdo con la fórmula.
La diferencia en las capacidades de los átomos de carbono y silicio para formar dobles enlaces tiene importantes consecuencias en el medio natural. Debido a que los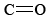 dobles enlaces se forman fácilmente, el dióxido de carbono consiste en moléculas individuales, no hay “espacios vacíos” en los átomos de carbono u oxígeno donde se pueden compartir electrones adicionales. De ahí que haya poco para mantener una molécula de dióxido de carbono cerca de otra, y a temperaturas ordinarias las moléculas se mueven independientemente. A escala macroscópica esto significa que el dióxido de carbono tiene las propiedades de un gas. En el dióxido de silicio, por otro lado, fuertes enlaces covalentes unen todos los átomos de silicio y oxígeno juntos en una red tridimensional. A temperaturas ordinarias los átomos no pueden vibrar lejos de sus posiciones adjudicadas, y el dióxido de silicio tiene las propiedades macroscópicas de un sólido.
dobles enlaces se forman fácilmente, el dióxido de carbono consiste en moléculas individuales, no hay “espacios vacíos” en los átomos de carbono u oxígeno donde se pueden compartir electrones adicionales. De ahí que haya poco para mantener una molécula de dióxido de carbono cerca de otra, y a temperaturas ordinarias las moléculas se mueven independientemente. A escala macroscópica esto significa que el dióxido de carbono tiene las propiedades de un gas. En el dióxido de silicio, por otro lado, fuertes enlaces covalentes unen todos los átomos de silicio y oxígeno juntos en una red tridimensional. A temperaturas ordinarias los átomos no pueden vibrar lejos de sus posiciones adjudicadas, y el dióxido de silicio tiene las propiedades macroscópicas de un sólido.
Como gas, el dióxido de carbono es mucho más libre que el dióxido de silicio para circular por el medio ambiente. Puede ser removido de la atmósfera por las plantas en el proceso fotosintético y eventualmente devuelto al aire por medio de la respiración. Esta es una de las razones por las que la vida terrestre se basa en compuestos de carbono. Si no se dispusiera de un suministro de carbono procedente del dióxido de carbono atmosférico, los organismos vivos serían bastante diferentes en forma y estructura de los que conocemos en la tierra.
A los autores de ciencia ficción les gusta sugerir, debido a la relación periódica del carbono y el silicio, que la vida en algún planeta distante podría estar basada en el silicio. Sin embargo, es bastante difícil imaginar el mecanismo por el cual tales formas de vida obtendrían silicio de las rocas y el suelo de la superficie de su planeta. Ciertamente se enfrentarían a grandes dificultades si la combinación de silicio con oxígeno para formar dióxido de silicio fuera utilizada como fuente de energía. ¡Imagínese inhalar un sólido en lugar del dióxido de carbono gaseoso que se forma cuando el carbono se combina con el oxígeno durante la respiración en los organismos terrestres! Las propiedades macroscópicas que están determinadas por la estructura microscópica y la unión son cruciales incluso en actividades fundamentales como la vida y la respiración.


