6.18: Compuestos iónicos que contienen iones poliatómicos
- Page ID
- 75774
Cuando se incluyen iones poliatómicos, el número de compuestos iónicos aumenta significativamente. De hecho, la mayoría de los compuestos iónicos contienen iones poliatómicos. Ejemplos bien conocidos son el hidróxido de sodio (NaOH) con OH - como anión poliatómico, carbonato de calcio (CaCo 3) y nitrato de amonio (NH 4 NO 3), que contiene dos iones poliatómicos: NH + y NO 3 -.
En la siguiente tabla se da una lista de los iones poliatómicos más importantes, los cuales pueden ser utilizados como referencia mientras se aprenden las cargas de los iones poliatómicos. Muchos de ellos son oxianiones (iones poliatómicos que contienen oxígeno).
Tabla\(\PageIndex{1}\) Iones
| Cargar | Nombre | Fórmula |
|---|---|---|
| -3 | Fosfato | PO 4 3 - |
| Arsenato | ASo 4 3 - | |
| -2 | Carbonato | CO 3 2 - |
| Peróxido | O 2 2 - | |
| Sulfato | SO 4 2 - | |
| Sulfito | SO 3 2 - | |
| Cromato | CrO 4 2 - | |
| Dicromato | Cr 2 O 7 2 - | |
| Fosfato de hidrógeno | HPO 4 2 - | |
| -1 | Carbonato de hidrógeno (bicarbonato) | HCO 3 - |
| Superóxido | O 2 - | |
| Sulfato de hidrógeno | HSO 4 - | |
| Fosfato de dihidrógeno | H 2 PO 4 - | |
| Hidróxido | OH - | |
| Nitrato | NO 3 - | |
| Nitrito | NO 2 - | |
| Acetato | C 2 H 3 O 2 - o CH 3 COO - | |
| Cianuro | CN - | |
| Permanganato | MnO 4 - | |
| Perclorato | ClO 4 - | |
| Clorato | ClO 3 - | |
| Clorita | ClO 2 - | |
| Hipoclorito | ClO - | |
| +1 | Amonio | NH 4 + |
| Hidronio | H 3 O + |
Las propiedades de los compuestos que contienen iones poliatómicos son muy similares a las de los compuestos iónicos binarios. Los iones están dispuestos en una red regular y se mantienen unidos por fuerzas culómbicas de atracción. Los sólidos cristalinos resultantes suelen tener altos puntos de fusión (1500 °F para CaCo 3) y todos conducen electricidad cuando se funden.
La mayoría son solubles en agua y forman soluciones conductoras en las que los iones pueden moverse como entidades independientes. En general, los iones poliatómicos son incoloros, a menos que, como CrO 4 2 —o MnO 4 —, contengan un átomo de metal de transición. Los iones poliatómicos más cargados negativamente, al igual que sus homólogos monatómicos, muestran una clara tendencia a reaccionar con el agua, produciendo iones hidróxido; por ejemplo,
\[\ce{PO_{4}^{3-} + H_{2}O \rightarrow HPO_{4}^{2-} + OH^{-}} \nonumber \]
Es importante darse cuenta de que los compuestos que contienen iones poliatómicos deben ser eléctricamente neutros. En un cristal de sulfato de calcio, por ejemplo, debe haber números iguales de iones Ca 2 + y SO 4 2 — para que las cargas se equilibren. La fórmula es así CaSO 4. En el caso del sulfato de sodio, por el contrario, el ion Na + tiene sólo una sola carga. En este caso necesitamos dos iones Na + por cada ion SO 4 2 — para lograr la electroneutralidad. La fórmula es así Na 2 SO 4.
Estructuralmente, los iones poliatómicos son similares a los sólidos iónicos que vimos anteriormente. Un ejemplo de un compuesto iónico simple, NaCl, se ve a continuación, junto a un sólido iónico más complejo, AgClO 3 -. Observe cómo ambos están apretados y forman un patrón repetitivo, que le da a ambos compuestos fuerza y fragilidad. En el Clorato de Plata (AgClO 3 -), sin embargo, están presentes iones poliatómicos donde los iones Cl - están presentes en el Cloruro de Sodio (NaCl).

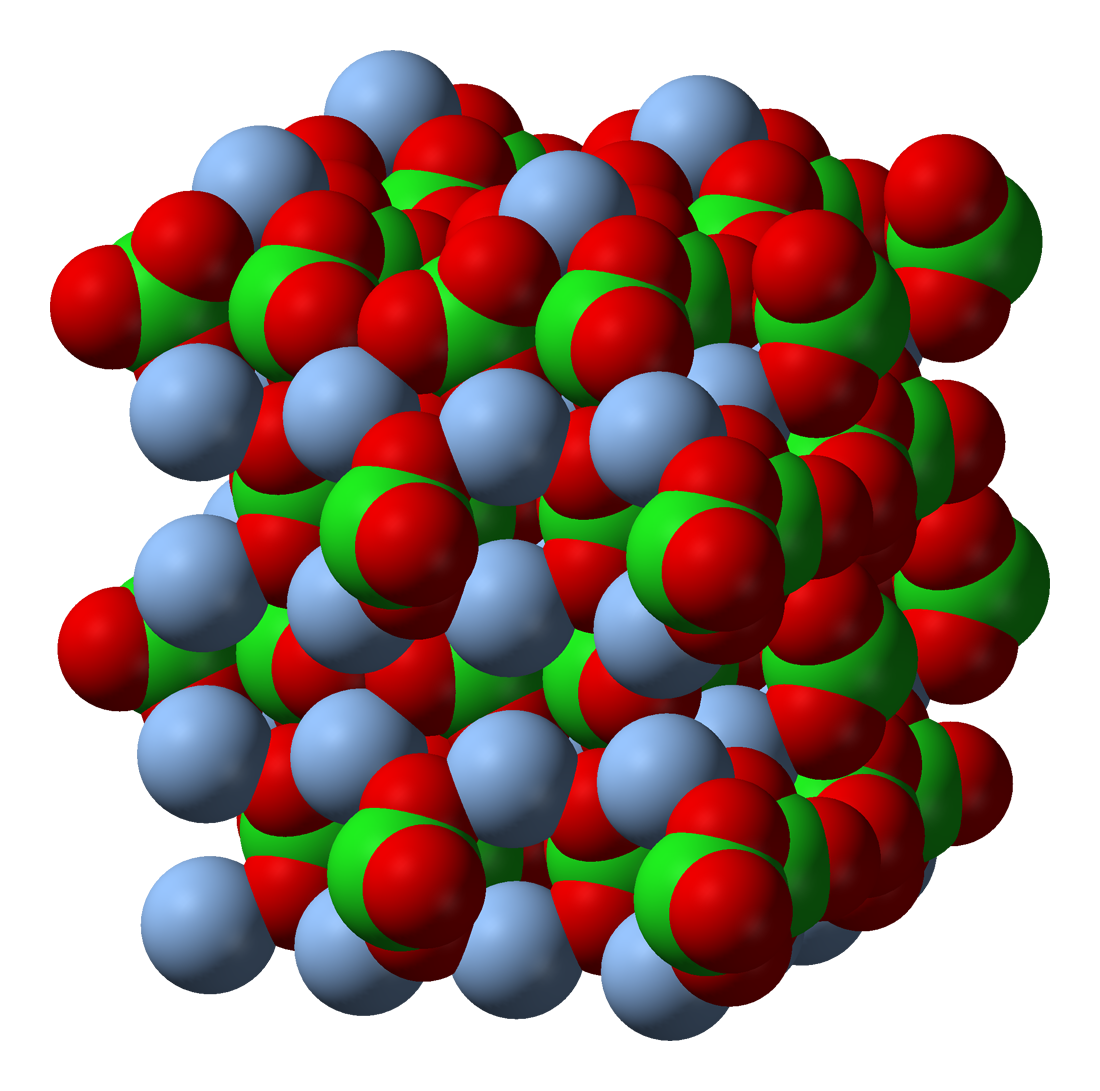
A la izquierda se encuentra la estructura reticular del sólido iónico NaCl, con Na representado por las esferas verdes y Cl representado por las esferas púrpuras. A la derecha se encuentra la estructura reticular de AgClO 3, con las esferas de plata representando Ag y las moléculas rojas y verdes representando el ion poliatómico ClO 3
¿Cuál es la fórmula del compuesto iónico fosfato de calcio?
Solución Es necesario tener la relación correcta de iones calcio, Ca 2 +, e iones fosfato, PO 4 3 —, para lograr la electroneutralidad. La relación requerida es la inversa de la relación de las cargas sobre los iones. Dado que los cargos están en la proporción de 2:3, los números deben estar en la proporción de 3:2. En otras palabras, la sal sólida debe contener tres iones calcio por cada dos iones fosfato:

La fórmula para el fosfato de calcio es, por lo tanto, Ca 3 (PO 4) 2.


