6.19: Tamaños atómicos
- Page ID
- 75745
Los tamaños de átomos e iones son importantes para determinar las propiedades de los compuestos covalentes e iónicos. Ya deberías tener alguna apreciación de los factores que rigen los tamaños atómicos a partir de los diagramas de densidad de puntos codificados por colores de hidrógeno, helio y litio y de berilio, boro y carbono. Del diagrama más a la izquierda a continuación, se puede ver que el Hidrógeno parece tener un radio atómico mayor que el helio, pero no mayor que el Litio (aunque su “radio” está bastante extendido). En el lado derecho, se puede ver que el radio atómico disminuye de manera constante a medida que avanza por la línea. Anote las ubicaciones relativas de estos elementos en la tabla periódica y prediga cuál podría ser la tendencia.
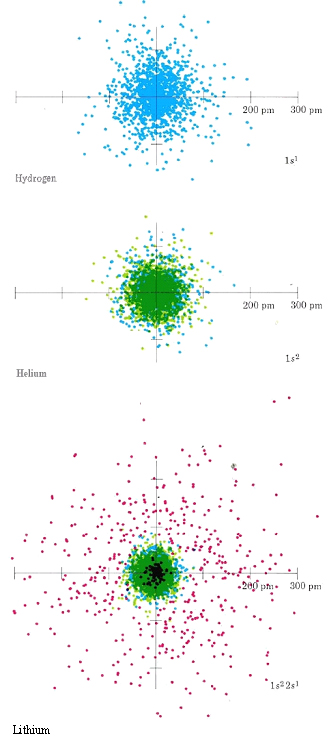
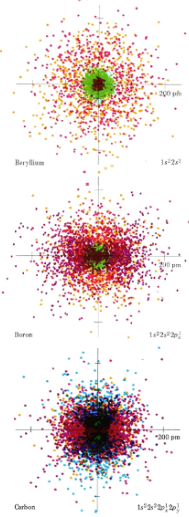
Con mucho, el átomo más grande ilustrado en estas placas de color es Li. Debido a que Li tiene un electrón en la cáscara n = 2, es más grande que H o He cuyas nubes de electrones de 1 s están mucho más cerca del núcleo. Li también es mayor que Be, B o C. En estos últimos átomos, las nubes de electrones de 2 s y 2 p son atraídas por una mayor carga nuclear y por lo tanto se mantienen más cerca del centro del átomo que la nube de 2 s en Li. Así, se pueden aplicar dos reglas importantes para la predicción de tamaños atómicos.
1 A medida que uno se mueve de arriba a abajo de la tabla periódica, el número cuántico principal n aumenta y los electrones ocupan orbitales cuyas nubes de electrones se encuentran sucesivamente más lejos del núcleo. Los radios atómicos aumentan.
2 A medida que uno se mueve de izquierda a derecha a través de un período horizontal, entonces el valor n de las nubes de electrones más externas sigue siendo el mismo, pero la carga nuclear aumenta constantemente. El aumento de la atracción nuclear contrae la nube de electrones, y por lo tanto el tamaño atómico disminuye.
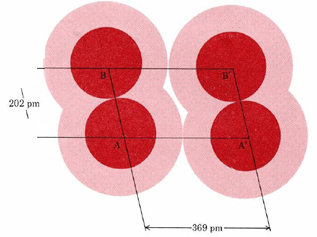
Es difícil medir el tamaño de un átomo muy exactamente. Como muestran los diagramas de densidad de puntos, un átomo no es como una bola de billar que tiene un radio definido. En lugar de detenerse repentinamente, una nube de electrones se desvanece gradualmente para que no se pueda apuntar a un radio definido en el que termina. Una forma de salir de esta dificultad es averiguar qué tan cerca se agrupan los átomos en una red cristalina. La Figura \(\PageIndex{2}\)ilustra parte de un cristal de Cl 2 sólido a una temperatura muy baja. La distancia AA′ tiene el valor de 369pm. Dado que esto representa la distancia entre átomos adyacentes en diferentes moléculas de Cl 2, podemos tomarla como la distancia a la que diferentes átomos de Cl simplemente “tocan”. La mitad de esta distancia, 184pm, se llama el radio van der Waals de Cl. El radio de van der Waals da una idea aproximada de cuán cerca los átomos en diferentes moléculas pueden acercarse entre sí.
Los valores comúnmente aceptados de los radios de van der Waals para los elementos representativos se muestran en la Figura \(\PageIndex{3}\). Observe cómo estos radios disminuyen y aumentan hacia abajo en la tabla periódica.

También se dan valores para el radio covalente de cada átomo. Volviendo a la figura de Cl 2 (Figura \(\PageIndex{2}\), vemos que la distancia AB entre dos átomos de Cl en la misma molécula (es decir, la longitud del enlace Cl—Cl) tiene un valor de 202pm. El radio covalente es la mitad de esta longitud de enlace, o 101pm. Los radios covalentes son aproximadamente aditivos y nos permiten predecir valores aproximados para las distancias internucleares en una variedad de moléculas. Por ejemplo, si agregamos el radio covalente de C (77 pm) al de O (66 pm), obtenemos una estimación para la longitud del enlace C―O, es decir, 143pm. Esto concuerda exactamente con el valor medido en alcohol etílico y éter dimetílico visto anteriormente.


